
【题目】工业炼铁过程中涉及到的主要反应有:
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
回答下列问题:
(1)![]() ________
________![]() 。
。
(2)![]() 时,向容积为
时,向容积为![]() 的恒容密闭容器中加入
的恒容密闭容器中加入![]()
![]() 和
和![]()
![]() 发生反应③,5min时达到平衡,平衡时测得混合气体中
发生反应③,5min时达到平衡,平衡时测得混合气体中![]() 的体积分数为80%,则0~5min内反应的平均速率
的体积分数为80%,则0~5min内反应的平均速率![]() ________
________![]() ,该温度下反应的平衡常数为________,下列选项中能够说明该反应已经达到平衡状态的是________(填标号)。
,该温度下反应的平衡常数为________,下列选项中能够说明该反应已经达到平衡状态的是________(填标号)。
A.固体的物质的量不再变化
B.体系的压强保持不变
C.混合气体的平均摩尔质量保持不变
D.单位时间内消耗![]() 和生成
和生成![]() 的物质的量相等
的物质的量相等
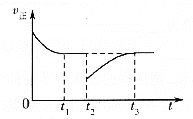
(3)一定条件下进行反应③,正向反应速率与时间的关系如图所示,![]() 时刻改变了一个外界条件,可能是________。
时刻改变了一个外界条件,可能是________。
(4)向密闭容器中加入足量的![]() 、
、![]() 和一定量的
和一定量的![]() 、
、![]() ,在
,在![]() 和
和![]() 下,反应③体系中
下,反应③体系中![]() 和
和![]() 的分压随时间变化的关系如图所示(已知温度:
的分压随时间变化的关系如图所示(已知温度:![]() )
)
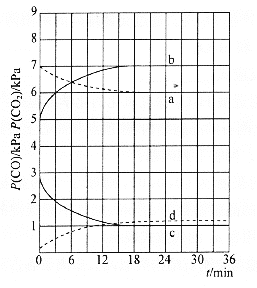
![]() 时,
时,![]() 随时间变化关系的曲线是________,
随时间变化关系的曲线是________,![]() 时,
时,![]() 随时间变化关系的曲线是________。向
随时间变化关系的曲线是________。向![]() 时已经达到平衡状态的反应③体系中再充入一定量的
时已经达到平衡状态的反应③体系中再充入一定量的![]() ,再次达到平衡时,
,再次达到平衡时,![]() 与
与![]() 的物质的量之比为________。
的物质的量之比为________。
【答案】-28 0.048 64 AC 恒压条件下充入一定量![]() a c 1:7
a c 1:7
【解析】
(1)根据盖斯定律进行ΔH3的计算;
(2)根据题干信息,列三段式求出CO转化的物质的量,从而求出0~5min内的平均反应速率和平衡常数,根据分析“变量”来判断是否能够作为反应达到平衡的标志;
(3)结合化学反应速率和平衡移动的影响因素进行分析解答;
(4)结合第(2)中的平衡常数,根据CO和CO2的浓度比通过阿伏伽德罗定律得出三个温度下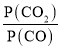 的大小关系,从而结合图像分析得出代表曲线,在根据温度不变,平衡常数不变求出比值。
的大小关系,从而结合图像分析得出代表曲线,在根据温度不变,平衡常数不变求出比值。
(1)由题干信息分析可得,反应③可通过反应![]() (④-②×3)得到,根据盖斯定律,ΔH3=
(④-②×3)得到,根据盖斯定律,ΔH3=![]() (ΔH4-3ΔH2)=
(ΔH4-3ΔH2)=![]() (460-3×172)=-28kJ·mol-1,故答案为:-28;
(460-3×172)=-28kJ·mol-1,故答案为:-28;
(2)T1时,向容积为10L的恒容密闭容器中加入3molFe2O3和3molCO发生反应③,平衡时测得混合气体中CO2的体积分数为80%,设CO转化了x mol,列三段式有:
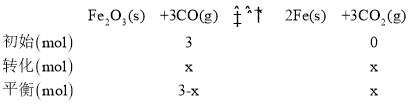
则![]() ,解得x=2.4mol,因此0~5min内反应的平均速率
,解得x=2.4mol,因此0~5min内反应的平均速率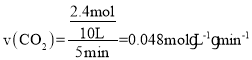 ,该温度下的平衡常数
,该温度下的平衡常数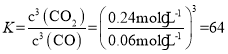 ;
;
A.由化学反应方程式可知,反应中固体的物质的量为一个变量,当固体的物质的量不再发生改变时,可以说明反应达到了平衡,A选项正确;
B.恒温恒容时,由阿伏伽德罗定律PV=nRT可知,体系的压强与气体的物质的量成正比,因为反应中气体的物质的量始终保持不变,所以体系压强始终不变,故体系的压强保持不变不能说明反应达到了平衡,B选项错误;
C.混合气体的平均摩尔质量=混合气体的总质量÷混合气体的物质的量,反应前后混合气体的总质量增加,总物质的量不变,则混合气体的平均摩尔质量为一个变量,当混合气体的平均摩尔质量保持不变时,可以说明反应达到了平衡,C选项正确;
D.单位时间内消耗CO和生成CO2都是正反应方向,不能说明反应达到了平衡,D选项错误;
答案选AC,故答案为:0.048;64;AC;
(3)由于该反应是一个反应前后气体体积不变的且正反应是放热的反应,根据图像变化趋势可知,在t2时v正减小,且重新平衡时等于原平衡的v正,平衡不移动,则改变的条件可能是在恒压条件下充入一定量的CO2气体,故答案为:在恒压条件下充入一定量的CO2气体;
(4)由(2)知,T1时,反应③的平衡常数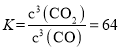 ,因为T1>T2>T3,所以T2、T3时,反应达到平衡后K3>K2>K,则达到平衡后,T3时的
,因为T1>T2>T3,所以T2、T3时,反应达到平衡后K3>K2>K,则达到平衡后,T3时的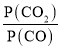 >T2时的
>T2时的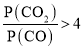 ,故曲线a表示T2时P(CO2)随时间变化的关系曲线,曲线d表示T2时P(CO)随时间变化的关系曲线,曲线b表示T3时P(CO2)随时间变化的关系曲线,曲线c表示T3时P(CO)随时间变化的关系曲线,由于温度不变,平衡常数不变,故向T3时已经达到平衡状态的反应③体系中再充入一定量的CO,再次达到平衡时,CO与CO2的物质的量之比仍为1:7,故答案为:a;c;1:7。
,故曲线a表示T2时P(CO2)随时间变化的关系曲线,曲线d表示T2时P(CO)随时间变化的关系曲线,曲线b表示T3时P(CO2)随时间变化的关系曲线,曲线c表示T3时P(CO)随时间变化的关系曲线,由于温度不变,平衡常数不变,故向T3时已经达到平衡状态的反应③体系中再充入一定量的CO,再次达到平衡时,CO与CO2的物质的量之比仍为1:7,故答案为:a;c;1:7。


科目:高中化学 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
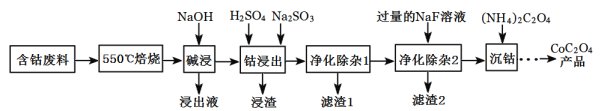
(1)“550℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃加入H2O2溶液,其目的是______。(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是______。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5mol/L,则滤液中c(Mg2+)为___[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
(6)为测定制得的CoC2O4产品的纯度,现称取1.000g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在平衡:I2(aq)+I-(aq)![]() I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如图。下列说法不正确的是
I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如图。下列说法不正确的是
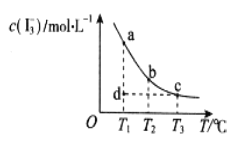
A.反应I2(aq)+I-(aq)![]() I3-(aq)的△H>0
I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态d时,一定有![]() 正>
正>![]() 逆
逆
D.状态a与状态b相比,状态a的c(I2)小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁的用途广泛,可以制备下图所示物质,下列说法错误的是( )
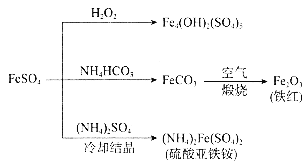
A.![]() 属于碱式盐,可用作净水剂
属于碱式盐,可用作净水剂
B.与足量![]() 反应的离子方程式为:
反应的离子方程式为:![]()
C.可用稀硫酸和![]() 溶液检验铁红中是否含有
溶液检验铁红中是否含有![]()
D.“冷却结晶”后的操作是过滤,“煅烧”操作的主要仪器有酒精灯、蒸发皿、玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法不正确的是( )
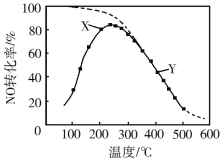
A.反应2NO(g)+O2(g)=2NO2(g)的ΔH<0
B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c起始(O2)=5.0×104mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是金刚石的晶胞结构,除顶点和面心上有碳原子外,4条体对角线的1/4处还各有1个碳原子。回答下列问题:

(1)若图中原子1的坐标为![]() ,则原子2的坐标为________。若金刚石的晶胞参数为
,则原子2的坐标为________。若金刚石的晶胞参数为![]() ,则其中碳碳键的键长
,则其中碳碳键的键长![]() ________pm(用含
________pm(用含![]() 的代数式表示)。
的代数式表示)。
(2)面心立方![]() 晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。
晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。
①S元素及其同周期的相邻元素第一电离能由小到大的顺序是________,二氯化硫(![]() )分子中S原子的杂化类型是________。
)分子中S原子的杂化类型是________。
②写出基态![]() 的电子排布式________;把晶胞示意图中表示
的电子排布式________;把晶胞示意图中表示![]() 的小球全部涂黑_______。
的小球全部涂黑_______。
③锌锰干电池中![]() 可吸收电池反应产生的
可吸收电池反应产生的![]() 生成
生成![]() ,该离子中含有________个
,该离子中含有________个![]() 键。
键。
④若该![]() 晶胞的晶胞参数为
晶胞的晶胞参数为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)
(列出计算式)
(3)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如有文献报道氨晶体中每个氢原子都形成氢键,则每个![]() 与周围________个
与周围________个![]() 通过氢键相结合。
通过氢键相结合。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A. 反应在前2 s 的平均速率v(O2) = 0.4 mol·L-1·s-1
B. 保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C. 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率小于10%
D. 保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为___,G的原子结构示意图是___。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为___,所含化学键类型为___。向甲中滴加足量水时发生反应的化学方程式是___。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是___。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则a极是该电池的___极,负极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HI常用作有机反应中的还原剂,受热会发生分解反应。已知![]() 时:
时:![]() ,向1L密闭容器中充入1molHI,
,向1L密闭容器中充入1molHI,![]() 时,体系中
时,体系中![]() 与反应时间t的关系如图所示。下列说法中,正确的是
与反应时间t的关系如图所示。下列说法中,正确的是

A.![]() min内的平均反应速率可表示为
min内的平均反应速率可表示为![]()
![]()
B.升高温度,再次平衡时,![]()
![]()
C.该反应的化学平衡常数计算式为![]()
D.反应进行40min时,体系吸收的热量约为![]() kJ
kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com