
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
分析 ①HSO3-的电离方程式为:HSO3-?H++SO32-,平衡常数表达式为K=$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$;
②根据酸性强弱H2SO3>H2CO3>HSO3-判断反应的离子方程式;
③HSO3-既能水解又能电离,HSO3-的电离常数Ka2=6.3×10-8,HSO3-+H2O?H2SO3+OH-,设水解平衡常数为Kh,则Kh=$\frac{{K}_{w}}{{K}_{a1}}$=$\frac{1{0}^{-14}}{1.3×1{0}^{-2}}$≈7.7×10-13<Ka2,以此比较.
解答 解:①HSO3-的电离方程式为:HSO3-?H++SO32-,平衡常数表达式为K=$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$,
故答案为:$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$;
②由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O,
故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O;
③HSO3-既能水解又能电离,HSO3-的电离常数Ka2=6.3×10-8,HSO3-+H2O?H2SO3+OH-,设水解平衡常数为Kh,则
Kh=$\frac{{K}_{w}}{{K}_{a1}}$=$\frac{1{0}^{-14}}{1.3×1{0}^{-2}}$≈7.7×10-13<Ka2,由此可知HSO3-电离程度大于水解程度,其溶液呈酸性,
答:NaHSO3溶液显酸性.
点评 本题考查电解质溶液,涉及盐的水解原理的应用、电离常数的应用、离子浓度大小比较等,侧重于考查学生的分析能力和对基础知识的综合应用能力,题目难度不大.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | ||||||
| B. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,离子方程式为:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | ||||||
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | ||||||
| D. | 碳酸和次氯酸的电离平衡常数见表,二氧化碳通入次氯酸钠溶液中:2NaClO+CO2+H2O═Na2CO3+2HClO
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.
已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molNaN3所含阴离子总数为3NA | |
| B. | 常温常压下,28 g乙烯气体中σ键与π键数目之和为6NA | |
| C. | 标准状况下,22.4L C12通入到足量FeBr2溶液中,被氧化的Br-数目为2NA | |
| D. | 500 mL 18 mol/L的H2SO4溶液与足量Cu共热,电子转移数目为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中少量SO2气体,可将气体通过饱和碳酸氢钠溶液洗气 | |
| B. | 除去乙醇中含有的少量水,可加入生石灰,然后进行蒸馏 | |
| C. | 滴定管使用前需要检漏,装溶液时需要润洗 | |
| D. | 除去乙酸乙酯中的少量乙酸,可加入饱和碳酸钠溶液除去乙酸,再进行蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的热稳定性:D>E | |
| B. | 原子半径:A<B<C<D<E | |
| C. | B与C形成的化合物中不可能含共价键 | |
| D. | 最高价氧化物对应的水化物酸性最强的是E |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
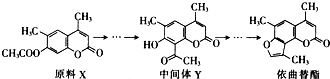
| A. | X与Y互为同分异构体 | |
| B. | X与Y均不能使酸性KMnO4溶液褪色 | |
| C. | 在光照条件下,依曲替酯中的苯环能与Cl2发生取代反应 | |
| D. | 依曲替酯中所有不饱和键均能与溴发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | ①滴加稀HNO3 ②滴加BaCl2溶液 | 无明显现象 白色沉淀 | 原溶液一定含SO${\;}_{4}^{2-}$ |
| B | 滴加稀盐酸 | 有大量气泡产生 | 原溶液一定含CO${\;}_{3}^{2-}$ |
| C | ①滴加稀HCl ②滴加AgNO3溶液 | 无明显现象 白色沉淀 | 原溶液一定含Cl- |
| D | ①滴加KCSN溶液 ②滴加氯水 | 无明显现象 溶液呈红色 | 原溶液一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| C. | Na2Y2与水发生氧化还原反应时,Na2Y2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com