


分析 海藻灰浸泡后过滤得到含碘离子的溶液,在碘化钾溶液中加入新制氯水发生Cl2+2KI═2KCl+I2,X为碘的水溶液,在反应后的溶液中加入四氯化碳萃取,Y为碘的四氯化碳溶液,蒸馏的得到碘,以此解答该题.
解答 解:海藻灰浸泡后过滤得到含碘离子的溶液,在碘化钾溶液中加入新制氯水发生Cl2+2KI═2KCl+I2,X为碘的水溶液,在反应后的溶液中加入四氯化碳萃取,Y为碘的四氯化碳溶液,蒸馏的得到碘,
(1)根据流程可知,分离不溶物与溶液的方法为过滤,因为碘在有机溶剂中的溶解度比水大,且碘和有机溶剂易于分离,所以用萃取;
故答案为:过滤;萃取;
(2)四氯化碳不溶于水,比水重,碘单质在四氯化碳中溶解度大于水中,四氯化碳层为紫红色,上层为主要溶质是氯化钾;
故答案为:紫红;KCl;
(3)F为碘的四氯化碳溶液,得到碘单质还需进行的操作是蒸馏,故答案为:蒸馏.
点评 本题以碘的提取为载体综合考查物质的分离、提纯,为高考常见题型,侧重于学生的分析、实验能力的考查,掌握过滤、萃取、蒸馏等操作是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1.6gCH4中含有的分子数 | |
| B. | 100 mL1mol/LH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下,22.4LCO气体中含有的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | B. | CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | ||
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | D. | 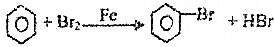 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、S2-、Cl- | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com