
【题目】KHSO4在水溶液中或熔融状态下,都能存在的离子是( )
A.K+
B.H+
C.HSO4﹣
D.SO42﹣
科目:高中化学 来源: 题型:
【题目】CO是重要的燃料和工业原料。目前,对CO的综合利用是科学家研究的热点。回答下列问题:
Ⅰ.工业制备CO的方法之一是甲烷氧化法。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802 kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol
③2CO(g)+O2(g)=2CO2(g) △H=-330 kJ/mol
(1)反应2CH4(g)+O2(g)=2CO(g)+4H2(g),△H=_________kJ/mol。
Ⅱ.CO也是制备AlCl3的副产品
制备AlCl3的原理为:2Al2O3(s)+6Cl2(g) ![]() 4AlCl3(g)+3O2(g) △H1
4AlCl3(g)+3O2(g) △H1
(2)已知该反应在较低温度下不能自发进行,则△H1_____0(填“>”“<”或“=”)
(3)制备AlCl3的实际生产过程中,常加入足量的碳粉,同时生成CO(g)。T1℃时,向恒容的密闭容器中加入5molAl2O3(s)、14molC(s)和6.4molCl2(g)发生反应。Cl2(g)的浓度变化如图(a)所示;图b为20min后改变容器中条件,平衡体系的反应速率(![]() )随时间(t)的变化关系,且四个阶段都各改变一种不同条件(该条件下制得的AlCl3为固态)。
)随时间(t)的变化关系,且四个阶段都各改变一种不同条件(该条件下制得的AlCl3为固态)。

①容器中发生反应的化学方程式为______________________________。
②0~15min内,用CO表示的该反应平均速率![]() =__________mol/(Lmin)
=__________mol/(Lmin)
③T1℃时,该反应的平衡常数K=______________(不需带单位)。
④40min时的平衡常数[K(40)]与15min时的平衡常数[K(15)]的大小关系:K(40)____K(15)(填“>”“<”或“=”)
⑤45min时,改变的条件为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况下,气体分子数相同的是( )
A.相同体积的CO和CO2
B.相同物质的量的H2O(g)和Cl2
C.在0℃时,1体积的O2和1体积的HCl
D.通常状况下71克Cl2和22.4LHCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,不正确的是( )
A.HCl=H++Cl-B.Na2SO4=Na++ SO42
C.NaHCO3=Na++ HCO3-D.NaHSO4=Na++ SO42+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去下列物质中混入的少量杂质(括号内为杂质),所选试剂和分离方法都正确的是( )
A.CH4(Cl2):饱和食盐水洗气
B.C2H4(SO2):NaOH溶液洗气
C.溴苯(Br2):NaOH溶液蒸馏
D.FeCl3溶液(CuCl2):铁粉过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z由如下反应得到:C4H9Br![]() Y
Y![]() Z,Z的结构简式不可能是( )
Z,Z的结构简式不可能是( )
A.CH3CH2CHBrCH2Br
B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3
D.CH2BrCBr(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示,其中R元素是短周期中除稀有气体之外原子半径最大的元素。下列说法正确的是
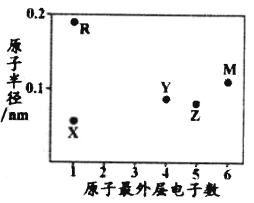
A. M元素在周期表中的位置是第2周期第ⅥA族
B. 元素的最高价氧化物对应水化物的酸性:Z<Y
C. X元素与Y、Z、M三种元素只能各形成一种共价化合物
D. Y、R的单质分别都能与其他物质反应置换出X单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)除去自来水中的Cl - 等杂质选择装置 _____(填代表装置图的字母,下同)。
(2)从碘水中分离出I2 ,选择装置 _____,该分离方法的名称为 __________。
(3)装置A中②的名称是 _______,①进出水的方向是 ________________。使用A装置时常常要在②中加入沸石或者碎瓷片,目的是 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知2C(s)+O2(g)=2CO(g) △H=—221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol1
C. 密闭容器中,0.3mol硫粉与0.2mol铁粉混合加热生成硫化亚铁0.2mol时,放出19.12 kJ热量。则Fe(s)+S(s)=FeS(s) △H= - 95.6 kJ·mol1
D. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= —38.6kJ·mol1
2NH3(g) △H= —38.6kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com