
| 46 |
| 46g/mol |


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案科目:高中化学 来源: 题型:
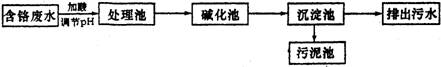
| A、当溶液中c(CH3COO-)=c (Na+)>c (H+)=c(OH-)时,一定是醋酸过量 |
| B、当溶液中c (CH3COO-)=c (Na+)时,一定是氢氧化钠过量 |
| C、当溶液中c (CH3COO-)=c (Na+)时,醋酸与氢氧化钠恰好完全反应 |
| D、当溶液中c (Na+)>c (CH3COO-)>c (OH-)>c (H+)时,一定是氢氧化钠过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气通过无水氯化钙粉末 |
| B、氢气通过灼热的氧化铜粉末 |
| C、铝与氧化铁发生铝热反应 |
| D、将锌粒投入到硝酸铜溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
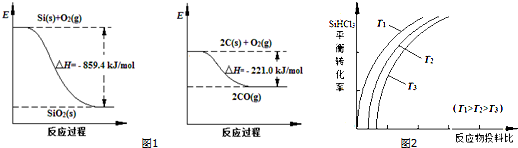
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
| 一定条件 |
| n(SiHCl3) |
| n(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:H2S>PH3>SiH4 |
| B、原子半径:Na>Mg |
| C、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D、结合质子能力:Cl->S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铜溶液中加过量的氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ |
| B、用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、用碘化钾淀粉溶液检验亚硝酸钠中NO2-的存在:NO2-+2I-+2H+═NO↑+I2+H2O |
| D、向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
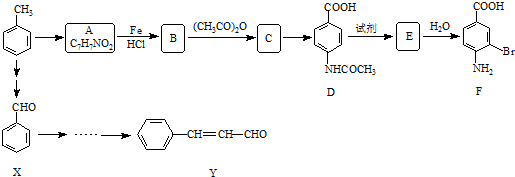
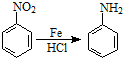 .2CH3CHO
.2CH3CHO| NaOH |
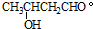
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO2 | 11.9 | 15.8 | 21.0 | 27.0 | -* | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| OH- |
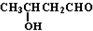
| -H2O |
| △ |
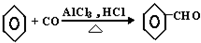
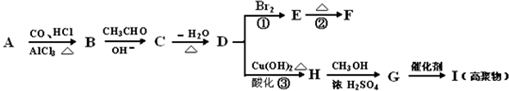

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com