
【题目】某化学兴趣小组设计实验,测定Na2CO3与NaHCO3混合物中Na2CO3的质量分数。
甲方案:
实验步骤为:①称量空坩埚的质量为A g
②称量装有试样的坩埚质量为B g ③加热
④冷却⑤称量坩埚和残余物的质量为C g
⑥重复③至⑤操作,直至恒重,质量为D g
(1)坩埚中发生反应的化学方程式为__________________。
(2)计算Na2CO3质量分数必须用到的测定数据为___________(填“A”、“B”、“C”或“D”)。
乙方案:
在天平上准确称取0.3000 g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.1000 mo1·L-1,的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为NaHCO3。重复上述操作两次,消耗盐酸的体积为20.00 mL。
(3)配制上述盐酸标准溶液100 mL,若用2.0 mol·L-1HCl进行配制,需用滴定管量取该HCl溶液________mL;定容时俯视刻度线,将导致配制的溶液浓度___________(填“偏高”、“偏低”或“没有影响”)。
(4)样品中Na2CO3的质量分数为___________(用百分数表示,精确到0.1%)。
丙方案:
称取m g样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
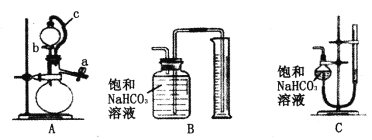
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b。若装置不漏气,则观察到的现象为__________________。实验时,装置A中c的作用_____________、_____________。
(6)为了提高测定的准确性,应选用装置A和__________(填写字母标号)进行实验。
【答案】(1)2NaHCO3![]() Na2CO3+CO2↑ +H2O ↑
Na2CO3+CO2↑ +H2O ↑
(2)A、B和D (3)5.0 偏高(4)70.7%
(5)无法确定(2分) 平衡气压,有利于液体流出(1分) 减小由于液体流下引起的体积误差 (1分)(6)C (1分)
【解析】
试题分析:(1)碳酸氢钠不稳定受热易分解,坩埚内发生反应是:2NaHCO3![]() Na2CO3+CO2↑ +H2O ↑;(2)此方案是先测量碳酸氢钠的质量,然后用总质量减去碳酸氢钠的质量,得到碳酸钠的质量,从而求出碳酸钠的质量分数,因此需要A和B,求碳酸氢钠的质量采用差量法求解,因此需要D的质量,C只是说明碳酸氢钠是否完全分解,不需要;(3)量筒的精确度是0.1ml,稀释前后溶质物质的量不变,即100*10-3*0.1=V(HCl)*10-3*2,解得V(HCl)=5.0ml,定容时,俯视度数,所配溶液的体积减少,浓度偏高;(4)三次消耗盐酸的体积分别是20.01、19.99、20.00,平均消耗盐酸体积为20.00ml,根据反应方程式:n(Na
Na2CO3+CO2↑ +H2O ↑;(2)此方案是先测量碳酸氢钠的质量,然后用总质量减去碳酸氢钠的质量,得到碳酸钠的质量,从而求出碳酸钠的质量分数,因此需要A和B,求碳酸氢钠的质量采用差量法求解,因此需要D的质量,C只是说明碳酸氢钠是否完全分解,不需要;(3)量筒的精确度是0.1ml,稀释前后溶质物质的量不变,即100*10-3*0.1=V(HCl)*10-3*2,解得V(HCl)=5.0ml,定容时,俯视度数,所配溶液的体积减少,浓度偏高;(4)三次消耗盐酸的体积分别是20.01、19.99、20.00,平均消耗盐酸体积为20.00ml,根据反应方程式:n(Na
2CO3)=0。212g,碳酸钠的质量分数为0.212/0.3000 *100%=70。7%;(5)c的作用是使分液漏斗中的压强和烧瓶中的压强相等,能够使液体顺利滴下,因此无法确定是否漏气;平衡分压,有利于液体流出;减小由于液体流下引起的体积误差;(6)通过排水法测量气体体积,B装置中导管含有水,这部分水是气体排出,无法读取体积,因此C装置可以减少误差。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol·Lˉ1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是
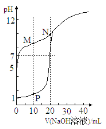
A.HX为弱酸
B.M点c(HX)-c(X-)﹥c(OH-)-c(H+)
C.将P点和N点的溶液混合,呈酸性
D.向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX) = c(Cl-) ﹥c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将金属钠放在燃烧匙中在空气中加热使其燃烧,不可能出现的现象是( )
A.金属钠熔化为小球
B.火焰为黄色
C.燃烧后得到一白色固体
D.燃烧后得到淡黄色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.硫酸氢铵溶液中滴加少量NaOH溶液:H++OH-=H2O
B.过量的SO2通入NaOH溶液中:SO2+2OH-=SO32—+H2O
C.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+CO32-
D.用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.在无色溶液中:NH4+、Fe2+、SO42﹣、CO32﹣
B.在含大量Ba2+的溶液中:NH4+、Na+、Cl﹣、NO3﹣
C.在强碱溶液中:Na+、K+、Cl﹣、HCO3﹣
D.在pH=1的溶液中:K+、Fe2+、Cl﹣、CH3COO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡 的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡 的1.8倍,下列叙述正确的是
A.a<c+d B.A的转化率增大
C.D的体积分数变大 D.平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z均为短周期元素,它们的原子核外最外层电子数分别为1、6、6,Z位于Y的上一周期,则这三种元素形成的某种化合物的化学式可能为( )
A.X2YZ4
B.XY2Z3
C.X3YZ4
D.XYZ3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com