
| A、升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动 |
| B、升高温度,可提高CO2转化率 |
| C、增加H2的浓度,可提高CO2转化率 |
| D、改用高效催化剂,可增大反应的平衡常数 |


科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 用铂丝蘸取溶液Y进行焰色反应 | 火焰呈黄色 | 溶液Y中含Na+,不含K+ |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了NaHCO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲是亚硫酸氢钠粉末投入稀硝酸溶液中有关图象 |
| B、乙是等PH值的MCl2和NCl2溶液稀释时PH值变化图,由此可推测M的金属性较强 |
| C、由丙可知,双氧水在有催化剂存在时的热化学方程式为2H2O2(l)=2H2O(l)+O2(g)△H=-2(Ea2′-Ea2) kJ?mol-1 |
| D、丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种 | B、5种 | C、6种 | D、7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光照 |
| B、加入NaOH固体 |
| C、加入水 |
| D、加入CaCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
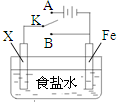
| A、若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | ||||
B、若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O
| ||||
| C、若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 | ||||
| D、若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①②③ |
| C、②③④ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com