

| ||
| 催化剂 |
| ||
| 催化剂 |
| ||
| 催化剂 |


科目:高中化学 来源: 题型:
| A、DNA中的碱基互补配对是通过氢键来实现的 |
| B、所有含氢元素的化合物中都存在氢键 |
| C、氢键属于分子间作用力,所以只存在分子之间 |
| D、能与水分子形成氢键的物质一般易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
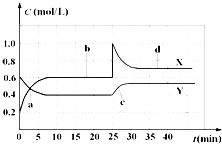 (选做)已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和 N2O4的混合气体通入容积为1L的恒温密闭容器中,反应物和生成物浓度随时间的变化关系如图所示.下列有关说法中错误的是( )
(选做)已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和 N2O4的混合气体通入容积为1L的恒温密闭容器中,反应物和生成物浓度随时间的变化关系如图所示.下列有关说法中错误的是( )| A、图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化 |
| B、a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d |
| C、若要达到与d相同的状态,在25 min时还能采取的措施是适当缩小容器体积 |
| D、反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
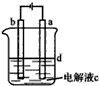 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示电解实验可制得白色的纯净的Fe(OH)2沉淀,两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示电解实验可制得白色的纯净的Fe(OH)2沉淀,两电极的材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:
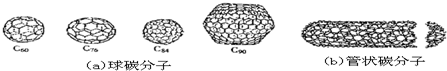
| A、金刚石和石墨的熔点肯定要比C60高 |
| B、据估计C60熔点比金刚石和石墨要高 |
| C、无论是球碳分子,还是管状碳分子、洋葱状碳分子,都应看作是碳的同素异形体 |
| D、球碳分子是碳的同素异形体,而管状碳分子、洋葱状碳分子则不一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCN分子中既含σ键又含π键 |
| B、CaCN2属于共价化合物 |
| C、每消耗10g CaCO3生成2.24L CO2 |
| D、CO为氧化产物,H2为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合酸中NO3-物质的量为0.1 mol |
| B、乙中最多产生气体是0.2mol |
| C、原混合酸中HNO3浓度为1.0 mol?L-1 |
| D、原混合酸中H2SO4浓度为2.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阴离子 Ksp 阳离子 | CO32- | F- | OH- |
| Ca2+ | 5.0×10-9 | 1.5×10-10 | 4.7×10-6 |
| Mg2+ | 3.8×10-6 | 7.4×10-11 | 5.6×10-12 |
| Mn2+ | 2.2×10-11 | 5.3×10-3 | 2.1×10-13 |
| Zn2+ | 1.2×10-10 | 3.0×10-2 | 6.9×10-17 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com