
| A. | 乙烯能使溴水、酸性高锰酸钾溶液褪色,褪色的本质相同 | |
| B. | 乙烷和乙烯分别与C12反应均有1.2二氯乙烷生成,且反应类型不同 | |
| C. | 油脂、葡萄糖、蛋白质都是人体重要的营养物质,它们都能水解 | |
| D. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
分析 A.乙烯与溴水发生加成反应,乙烯与高锰酸钾发生氧化反应;
B.乙烷与氯气发生取代反应,乙烯与氯气发生加成反应;
C.油脂含-COOC-、蛋白质含-CONH-,而葡萄糖为单糖;
D.乙酸乙酯与NaOH发生水解反应.
解答 解:A.乙烯与溴水发生加成反应,乙烯与高锰酸钾发生氧化反应,反应类型不同,故A错误;
B.乙烷与氯气发生取代反应,乙烯与氯气发生加成反应,均有1.2二氯乙烷生成,故B正确;
C.油脂含-COOC-、蛋白质含-CONH-,均可发生水解反应,而葡萄糖为单糖,葡萄糖不能发生水解反应,故C错误;
D.乙酸乙酯与NaOH发生水解反应,不能除杂,应选饱和碳酸钠溶液除杂,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意反应类型的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成3n mol X,同时生成n mol Y | |
| B. | 2v逆(Y)=v正(Z) | |
| C. | X、Y、Z的浓度相等 | |
| D. | X、Y、Z的分子个数比为3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K随压强的改变而改变 | B. | K越大,C的平衡浓度越小 | ||
| C. | C的起始浓度越大,K值越大 | D. | K越大,反应进行的程度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个,则可证明醋酸是弱电解质 | |
| C. | 取等体积等浓度的CH3 COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质 | |
| D. | 测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3═Fe3++Cl3- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | KMnO4═K++Mn7++4O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4g氢气中含有的原子数是2mol | |
| B. | 4g氢气所占的体积是44.8L | |
| C. | 4g氢气的物质的量是2mol | |
| D. | 4g氢气与44.8L氧气所占有的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中:Ca2+、Na+、PO43-、NO3- | |
| B. | 0.1 mol•L-1Na2S溶液中:Ag+、Fe3+、NO3-、Cl- | |
| C. | 无色溶液中:K+、H+、Cl-、MnO4- | |
| D. | 0.1 mol•L-1 NaOH溶液中:K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
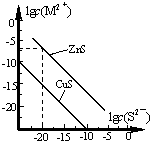 25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )| A. | Na2S 溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃时,Ksp(CuS)约为1×10-35 | |
| C. | 向100 mL Zn2+、Cu2+浓度均为10-5 mol/L 的混合溶液中逐滴加入10-4mol/L 的Na2S 溶液,Cu2+先沉淀 | |
| D. | 向Cu2+浓度为10-5 mol/L 的工业废水中加入ZnS 粉末,会有CuS 沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com