
| A、OH-的摩尔质量为17 g |
| B、标准状况下,22.4L水中含有的水分子数目为NA |
| C、24 g Mg变成Mg2+时转移电子的数目是NA |
| D、0.5 NA个Cl2的物质的量是0.5 mol |
| N |
| NA |
| N |
| NA |
| 0.5NA |
| NA |


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
| A、A2>B2>C2>D2 |
| B、B2>A2>C2>D2 |
| C、C2>B2>A2>D2 |
| D、D2>C2>B2>A2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,120g二氧化硅固体中,含有2NA个二氧化硅分子 |
| B、标准状况下,18g重水含有10NA个中子 |
| C、室温下,46克二氧化氮与四氧化二氮混合气体中原子数是3NA |
| D、常温常压下,过氧化钠与过量水反应,生成0.2摩氧气,转移电子0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78g Na2O2与足量水充分反应时电子转移数为2NA |
| B、NA个氯气分子的体积为22.4L |
| C、4℃、101kPa时,54mL H2O中含有的分子数为3NA |
| D、2L 1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
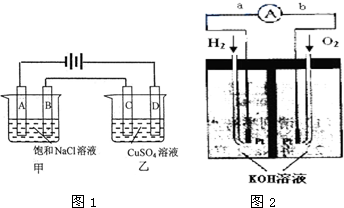 电解原理在化学工业上有着广泛的应用,按图1所示所示装置进行电解实验.A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入酚酞试液.工作一段时间后:
电解原理在化学工业上有着广泛的应用,按图1所示所示装置进行电解实验.A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入酚酞试液.工作一段时间后:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、盐酸的体积为80mL |
| B、a的取值范围为0<a<50 |
| C、n(Mg2+)≥0.025mol |
| D、当a值为30时,b值为0.02 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com