
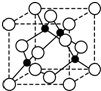
 A、B、C、D、E、F均为周期表中前四周期元素,其原子序数依次增大,其中A、B、C为短周期非金属元素.A是形成化合物种类最多的元素;B原子基态电子排布中只有一个未成对电子;C是同周期元素中原子半径最小的元素,且B、C同主族.D的基态原子在前四周期元素的基态原子中单电子数最多;E 与D相邻,E的某种氧化物X与C的氢化物的浓溶液加热时反应常用于实验室制取气态单质C;F与D的最外层电子数相等.
A、B、C、D、E、F均为周期表中前四周期元素,其原子序数依次增大,其中A、B、C为短周期非金属元素.A是形成化合物种类最多的元素;B原子基态电子排布中只有一个未成对电子;C是同周期元素中原子半径最小的元素,且B、C同主族.D的基态原子在前四周期元素的基态原子中单电子数最多;E 与D相邻,E的某种氧化物X与C的氢化物的浓溶液加热时反应常用于实验室制取气态单质C;F与D的最外层电子数相等.| 7+1-2×3 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 99.5 |
| NA |
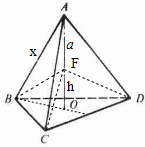 ,连接F与A、B、C、D,则三棱锥A-BCD均分为等4个等体积的三棱椎,则V三棱锥A-BCD=4V三棱锥F-BCD=,故
,连接F与A、B、C、D,则三棱锥A-BCD均分为等4个等体积的三棱椎,则V三棱锥A-BCD=4V三棱锥F-BCD=,故| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| ||
| 2 |
| 2 |
| 3 |
| ||
| 3 |
| ||
| 3 |
| 1 |
| 3 |
2
| ||
| 3 |
| ||
| 2 |
| ||
| 2 |
2
| ||
| 3 |
4
| ||
| 3 |
4
| ||
| 3 |
| 64 | ||
3
|
4×
| ||||
|
199×3
| ||
| 32a3NA |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素周期表中位于金属和非金属非界线附近的元素属于过渡元素 |
| B、短周期元素中,元素符号用一个大写英文字母表示的元素共有7种 |
| C、第三周期元素的最高正化合价等于它所处的主族序数 |
| D、共价化合物中各原子都一定满足最外层8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、800℃下,该反应的化学平衡常数为0.25 |
| B、427℃时该反应的平衡常数为9.4,则该反应的△H>0 |
| C、800℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3% |
| D、800℃下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
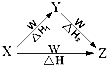 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式△H=△H1+△H2.则X、Y可能是①C、CO ②AlCl3、Al(OH)3③Fe、Fe(NO3)2④Na2CO3、NaHCO3( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式△H=△H1+△H2.则X、Y可能是①C、CO ②AlCl3、Al(OH)3③Fe、Fe(NO3)2④Na2CO3、NaHCO3( )| A、①②③④ | B、①② |
| C、③④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KOH和 Al2(SO4)3 |
| B、Na2CO3和HCl |
| C、氨水和Al2(SO4)3 |
| D、NaAlO2和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高体系温度,反应速率加快,平衡常数K增大 | ||
| B、增加B的量,平衡正向移动 | ||
C、平衡常数表达式为K=
| ||
| D、改变压强,平衡不发生移动,反应放出的热量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com