
| 物质 | 杂质 | 试剂或用品 | 主要操作 | |
| A | 淀粉 | 碘化钾 | 半透膜 | 渗析 |
| B | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
| C | Fe | I2 | / | 加热 |
| D | 溴 | 四氧化碳 | 蒸馏装置 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:实验题
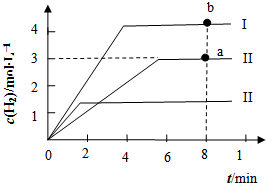 【化学-选修2化学与技术】
【化学-选修2化学与技术】| 化学键 | C≡O | O═O | C═O(CO2中) |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
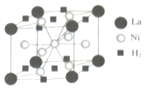 钒和镍及其化合物是重要的催化剂和合金材料.请回答:
钒和镍及其化合物是重要的催化剂和合金材料.请回答: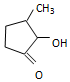 可形成配合物.
可形成配合物. 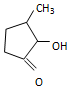 中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.
中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
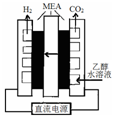 氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:
氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
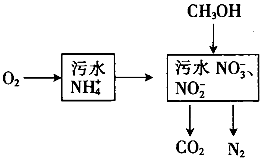 处理生活污水中的NH4+,过程如下:
处理生活污水中的NH4+,过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙、丁四种元素均为短周期元素 | |
| B. | 元素丁形成的化合物比元素乙形成的化合物少 | |
| C. | 气态氢化物的稳定性比较:甲>乙 | |
| D. | 最高价氧化物对应水化物的酸性比较:甲<丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44g丙烷含有共价键的数目为10NA | |
| B. | 1 L 1 mol•L-1的Na2CO3溶液中含有氧原子的数目为3NA | |
| C. | 常温常压下,11.2L由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,电解质溶液中K+移向负极 | |
| B. | 放电时,电解质溶液的pH 不变 | |
| C. | 充电时,阴极的反应为:Zn(OH)42-+2e-=Zn+4OH- | |
| D. | 充电时,当有4.48L 氧气(标准状况下)释放出来时,则析出固体Zn为13g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com