
 ,氮元素位于元素周期表中第二周期,第ⅤA族,最外层有5个电子,其气态氢化物原子间通过共用电子对形成共价键,所以其电子式为:
,氮元素位于元素周期表中第二周期,第ⅤA族,最外层有5个电子,其气态氢化物原子间通过共用电子对形成共价键,所以其电子式为: ,故答案为:
,故答案为: ;
; .
.| 207 |
| 23 |


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
| A、若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B、由水溶液的酸性:HCI>H2S,可推断出元素的非金属性:CI>S |
| C、邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键 |
| D、H-F、H-O、H-N三种共价键的极性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无水硫酸铜的吸水性较浓硫酸强 |
| B、将石灰石、纯碱、石英在玻璃熔炉中高温熔融可制得玻璃 |
| C、把铜片和铁片用导线连接后一起插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、取5mL 0.1 mol?L-1 FeCl3溶液,滴加0.1 mol?L-1 KI溶液5~6滴,再加入少量KSCN溶液,溶液呈红色,说明该反应有一定的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸 纯碱 孔雀石[Cu2(OH)2CO3] |
| B、硝酸 烧碱 绿矾[FeSO4?7H2O] |
| C、醋酸 乙醇 碳酸钙 |
| D、盐酸 熟石灰 苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学键断裂时要吸收能量,形成新化学键时要放出能量 |
| B、化学变化的实质是旧化学键断裂,新化学键形成 |
| C、在化学变化过程中,一定要吸收或放出能量 |
| D、吸收能量或放出能量的过程,一定是化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
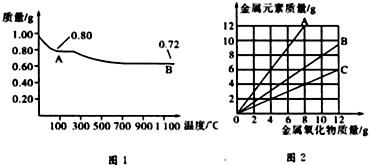
| A、图1中,A到B的过程中有0.01 mol电子发生了转移 |
| B、图1整个过程中共生成0.26 g水 |
| C、图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A |
| D、图1中A和B化学式分别为Cu2O和CuO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com