

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀时的pH | 7.0 | 1.9 | 3.4 |
| 沉淀完全时的pH | 9.0 | 3.2 | 4.7 |
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏 | 得黄棕色溶液 | |
| 水,充分搅拌,静置,滤去沉淀. | ||
| 溶液中不含Fe2+ | ||
| 溶液中含有SO42- |
| 1.38t |
| 69g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 编号 | 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度/℃ |
| A | Mg,0.1 | 5mol/L盐酸10mL | 60 |
| B | Mg,0.1 | 3mol/L盐酸10mL | 60 |
| C | Fe,0.1 | 3mol/L盐酸10mL | 60 |
| D | Mg,0.1 | 3mol/L盐酸10mL | 50 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度的溶液时,若加水超过容量瓶的刻度线,用胶头滴管将多余液体吸出即可 |
| B、区别Na2CO3和NaHCO3时,可将它们分别和Ca(OH)2溶液混合,看有无沉淀产生 |
| C、区别FeCl3溶液和Fe(OH)3胶体时,可将它们分别用一束光照射,看有无丁达尔效应出现 |
| D、检验某溶液中是否含有NH4+离子时,可加入适量的氢氧化钠溶液并加热,再用湿润的蓝色石蕊试纸检验产生的气体即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO
| ||||
B、二氧化碳通入碳酸钠溶液中 CO2+CO
| ||||
| C、金属钠投入水中 Na+2H2O=Na++2OH-+H2↑ | ||||
| D、氯气通入冷的氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
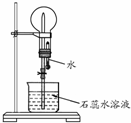 A是一种白色晶体,受热分解能生成B、C两种无色气体,C的水溶液与硝酸银溶液反应产生白色沉淀.A与浓NaOH溶液共热,放出无色气体B.若在圆底烧瓶中分别收集干燥的气体B和C,然后将收集满气体的烧瓶按如图所示装置组装,挤压滴管的胶头时,可以分别得到蓝色喷泉和红色喷泉.
A是一种白色晶体,受热分解能生成B、C两种无色气体,C的水溶液与硝酸银溶液反应产生白色沉淀.A与浓NaOH溶液共热,放出无色气体B.若在圆底烧瓶中分别收集干燥的气体B和C,然后将收集满气体的烧瓶按如图所示装置组装,挤压滴管的胶头时,可以分别得到蓝色喷泉和红色喷泉.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | 加入NaCl的物质的量(mol) | 测得溶液中Cl-物质的量(mol) | 测得溶液中Cu2+物质的量(mol) |
| 1 | 0.4 | 0 | 0.2 |
| 2 | 1 | 0 | 0 |
| 3 | 1.2 | 0 | 0 |
| 4 | 2 | 0 | 0 |
| 5 | 2.4 | 0.4 | 0 |
| 6 | 3 | 1 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com