
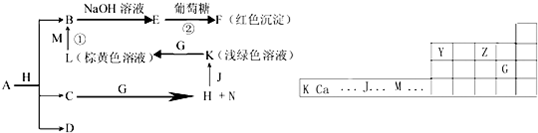
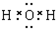 ,
,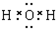 ;
;| △ |
| △ |


科目:高中化学 来源: 题型:


| ||
| ρg?cm-3 |
| ||
| ρg?cm-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
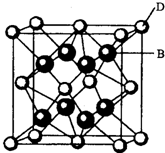 【化学一一选修物质结构与性质】
【化学一一选修物质结构与性质】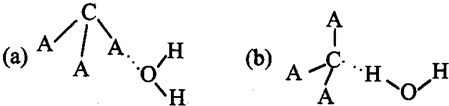
查看答案和解析>>
科目:高中化学 来源:2013届内蒙古呼伦贝尔牙克石林业一中高三第二次模拟化学试卷(带解析) 题型:填空题
(15分)六种短周期元素在周期表中的相对位置如下所示,其中E元素原子核外电子总数是其最外层电子数的3倍。关于元素周期表及这六种元素性质,请回答:
| A | B | C |
| D | E | F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com