
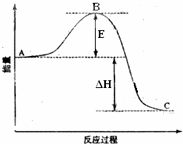
22SO2(g)+O2(g)⇌2SO3(g)反应过程的能量变化如图所示.
已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJ•mol﹣1.请回答下列问题:
(1)图中C表示 ;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,理由是 ;
(2)图中△H= kJ•mol﹣1;
(3)如果反应速率υ(SO2)为0.05mol•L﹣1•min﹣1,则υ(O2)= mol•L﹣1•min﹣1;
(4)已知单质硫的燃烧热为296KJ•mol﹣1,计算由S(s)生成3mol SO3(g)的△H= .
| 化学能与热能的相互转化. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | (1)C表示生成物总能量,该反应通常用V2O5作催化剂,催化剂能降低反应所需要的能量,提高活化分子百分数,降低反应的活化能; (2)根据参加反应SO2的物质的量之比等于对应的△H之比; (3)依据化学反应速率之比等于系数之比计算得到5; (4)依据燃烧热的概念和热化学方程式,结合盖斯定律计算得到. |
| 解答: | 解:(1)因图中C分别表示生成物总能量,该反应通常用V2O5作催化剂,催化剂能降低反应所需要的能量,提高活化分子百分数,降低反应的活化能, 故答案为:生成物总能量;催化剂能降低反应所需要的能量,提高活化分子百分数; (2)因1mol SO2(g)氧化为1mol SO3的△H=﹣99kJ•mol﹣1,所以2molSO2(g)氧化为2molSO3的△H=﹣198kJ•mol﹣1,则2SO2(g)+O2(g)=2SO3(g)△H=﹣198KJ•mol﹣1,故答案为:﹣198; (4)反应的化学方程式为:2SO2(g)+O2(g)⇌2SO3(g),反应速率之比等于系数之比,v(SO2):v(O2):v(SO3)=2:1:2,反应速率υ(SO2)为0.05mol•L﹣1•min﹣1,依据比例计算得到v(O2)=0.025mol/L•min,故答案为:0.025; (5)单质硫的燃烧热为296kJ•mol﹣1,热化学方程式为:①S(s)+O2(g)=SO2(g)△H1=﹣296 KJ•mol﹣1,已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJ•mol﹣1.热化学方程式为: ②SO2(g)+1/2O2(g)⇌SO3(g)△H2=﹣99 KJ•mol﹣1; 依据盖斯定律,②+①得到:③S(s)+O2(g)=SO3(g)△H=(△H1+△H2)KJ/mol; 则S(s)生成3molSO3(g)③×3得到3 S(s)+9/2O2(g)=3SO3(g)△H=3(△H1+△H2)=﹣1185 KJ•mol﹣1,故答案为:﹣1185 KJ•mol﹣1. |
| 点评: | 本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大,注意活化能与反应热的关系. |


科目:高中化学 来源: 题型:
下列说法不正确的是()
A. 电解池是将电能转化成化学能的装置
B. 化学键断裂时吸收能量,形成时放出能量
C. 增大反应物的浓度,可增加单位体积内活化分子数,从而使反应速率增大
D. 含0.1molH2SO4的浓硫酸与含0.2molNaOH的溶液混合;放出的热量即为中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
分别向500 mL 0.5 mol·L-1的NaOH溶液中加入①稀醋酸、②稀硝酸、③浓H2SO4,恰好完全反应时的反应热分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1=ΔH2=ΔH3
C.ΔH1<ΔH3<ΔH2 D.ΔH2<ΔH3<ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少了0.6mol/L.此反应速率的表示正确的是( )
|
| A. | 用A表示的反应速率是0.4mol/(L•min) |
|
| B. | 用C表示的速率是0.2mol/(L•min) |
|
| C. | 在2min末的反应速率,用B表示是0.3mol/(L•min) |
|
| D. | 用D表示的反应速率是0.2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
以NA代表阿伏加德罗常数.关于热化学方程式:C2H2(g)+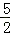 O2(g)=2CO2(g)+H2O(l)△H=﹣1300kJ/mol的说法正确的是
O2(g)=2CO2(g)+H2O(l)△H=﹣1300kJ/mol的说法正确的是
( )
|
| A. | 有10NA个电子转移时,该反应放出1300kJ的能量 |
|
| B. | 有NA个水分子生成且为液体时,吸收1300kJ的能量 |
|
| C. | 有2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
|
| D. | 有8NA个碳氧共用电子对生成时,放出1300kJ的能量 |
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:填空题
(10分)现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,其中物质E是气体丙的水溶液,物质H是红褐色沉淀。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出A、C、丙的化学式:
A 、 C 、 丙
(2)写出反应③的化学方程式: ,
反应⑤的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:选择题
有两种金属粉未的混合物26g,投入足量的稀硫酸中充分反应,产生11.2L标准状况时的氢气,此混合物可能是
A、Fe和Zn B、Al和Zn C、Mg和Al D、Fe和Cu
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列关于浓硫酸的叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.稀释浓硫酸时,先将浓硫酸加入烧杯中,再加入水并搅拌
C.浓硫酸是一种干燥剂,能够干燥氨气、氧气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏银川市高一下学期3月月考化学试卷(解析版) 题型:选择题
下列关于硝酸的叙述中正确的是
A. 稀硝酸是弱酸,浓硝酸是强酸
B. 铜与浓硝酸和稀硝酸都能发生反应生成二氧化氮
C. 浓硝酸能使紫色石蕊溶液先变红后褪色
D. 稀硝酸与活泼金属反应放出氢气,而浓硝酸则使金属钝化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com