
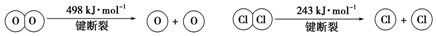
分析 ①反应A中,4mol HCl被氧化,放出115.6kJ的热量,依据热化学方程式书写方法,标注物质聚集状态和对应焓变写出;
②依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,焓变=反应物断键吸收热量-生成物形成化学键放出热量计算.
解答 解:①反应4HCl+O2$?_{400℃}^{CuO/CuCl_{2}}$2Cl2+2H2O中,4mol HCl被氧化,放出115.6kJ的热量,则反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 kJ/mol,
故答案为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 kJ/mol;
②焓变=反应物断键吸收热量-生成物形成化学键放出热量,4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 kJ/mol,
则该反应的焓变△H=4×E(H-Cl)+498-[243×2+4×E(H-O)]=-115.6,
即:4×E(H-O)-4×E(H-Cl)=498-486+115.6=127.6,整理可得:E(H-O)-E(H-Cl)=31.9,
故答案为:31.9.
点评 本题考查反应热与焓变的应用,题目难度中等,明确键能与焓变的关系为解答关键,注意掌握热化学方程式的书写原则,试题有利于提高学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
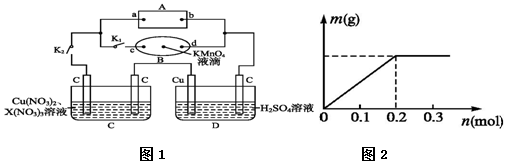
| A. | 开始加入合金的质量可能为5.6g | |
| B. | 参加反应的硝酸的物质的量为0.2mol | |
| C. | 沉淀完全时消耗NaOH溶液的体积为200mL | |
| D. | 标况下产物NO体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用于分离I2和NH4Cl | |
| B. |  用于测定某稀盐酸的物质的量浓度 | |
| C. | 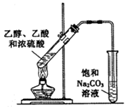 加热乙醇、乙酸和浓硫酸的混合液制取乙酸乙酯 | |
| D. |  滴入浓硫酸后,KMnO4溶液褪色,说明浓硫酸起到了脱水剂和氧化剂的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
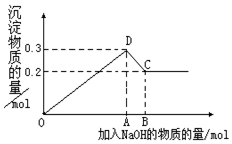 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Na2CO3 | C. | KAl(SO4)2•12H2O | D. | CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com