
 .
.
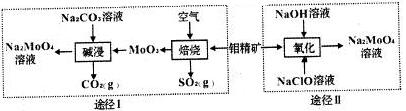
分析 利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:途径Ⅰ是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径Ⅱ是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体;据此分析解答:
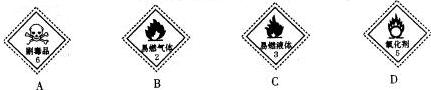
(1)NaClO是一种强氧化剂,是离子型化合物,含有Na+和ClO-;
(2)途径I碱浸时MoO3和纯碱溶液反应生成钼酸钠,同时得到CO2气体,反应方程式为MoO3+Na2CO3=Na2MoO4+CO2↑;
(3)途径Ⅱ用NaClO在碱性条件下氧化MoO3,得到钼酸钠和NaCl和水,据此可写出离子反应方程式;
(4)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,将NH3和CO2或SO2一起通入水中可生成碳酸盐或亚硫酸盐和水,反应方程式为CO2+2NH3+H2O=(NH4)2CO3或NH3+H2O+CO2=NH4HCO3,前者生成的盐为正盐,后者为酸式盐;
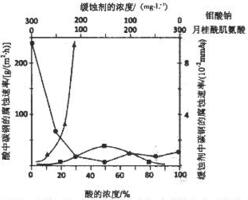
(5)①根据图象分析,在缓蚀剂中碳钢的腐蚀速率速率最小,腐蚀效果最好,最好的腐蚀效果在中点处;
②浓硫酸有强氧化性,能使金属表面形成致密的氧化膜保护层;
(6)常温下HClO的电离常数Ka=3.0×10-8,即HClO为极弱的酸,所以NaClO水解溶液呈碱性.
解答 解:利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:途径Ⅰ是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径Ⅱ是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体;据此分析解答:
(1)NaClO是一种强氧化剂,所以贴在装有NaClO容器上的是D,NaClO是离子化合物NaClO的电子式为 ,
,
故答案为:D; ;
;
(2)途径I碱浸时发生反应的离子方程式为MoO3+CO32-=MnO42-+CO2↑,
故答案为:MoO3+CO32-=MoO42-+CO2↑;
(3)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,
故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(4)CO2和NH3一起通入水中生成的酸式盐为碳酸氢铵,化学式为NH4HCO3,如果是SO2气体则生成酸式盐为NH4HSO3,
故答案为:NH4HSO3;NH4HCO3;
(5)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,
故答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,
故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
(6)常温下HClO的电离常数Ka=3.0×10-8,即HClO为极弱的酸,所以NaClO水解溶液呈碱性,所以在等浓度的NaClO和HClO的混合溶液中离子浓度由大到小的顺序为c(Na+)>c(ClO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(ClO-)>c(OH-)>c(H+).
点评 本题考查制备钼酸钠晶体的工业制备方法,涉及利用化学用语分析反应原理,解题关键是分析题中图示,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2固体中阴、阳离子个数比为1:1 | |
| B. | 由酸性HCl>H2CO3,可推知非金属性Cl>C | |
| C. | pH均为5的CH3COOH溶液和NH4Cl溶液中水的电离程度相同 | |
| D. | 常温下,浓度均为0.1mol/L的HA酸溶液与NaOH溶液等体积混合后(pH约为8),溶液中离子浓度关系:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
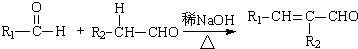 (R,R′为烃基或氢)
(R,R′为烃基或氢) (R,R′为烃基)
(R,R′为烃基)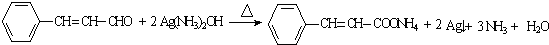 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0min时,三个实验的瞬间速率相同 | |
| B. | 不考虑温度影响,10min时,实验③的瞬间速率最快 | |
| C. | 0~20min内,实验①、②化学平均速率相等 | |
| D. | 实验①、②相比,实验②可能加了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55 mol | |
| D. | 若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率大于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
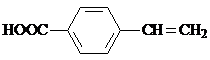
| A. | CH3CH=CH2 烯烃 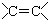 | B. | 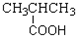 羧酸-COOH 羧酸-COOH | ||
| C. | 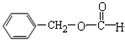 醛类 醛类 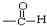 | D. | RCH2OH (R为烃基) 醇类-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
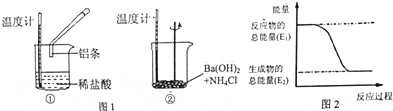
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 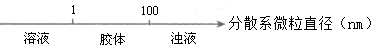 分散系的分类 | |
| B. | 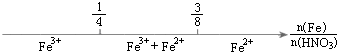 铁与稀硝酸反应后溶液中铁元素的存在形式 | |
| C. | 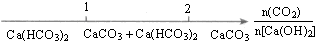 CO2通入澄清石灰水中反应的产物 | |
| D. | 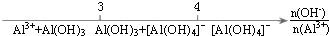 AlCl3溶液中滴加NaOH溶液后Al元素的存在形式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com