
| 离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| 浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
分析 (1)根据溶液中电荷守恒可计算出氢离子的浓度;
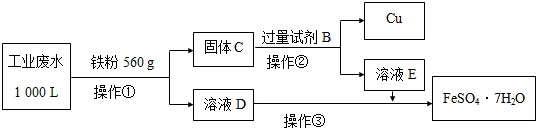
(2)某工厂的工业废水中含有大量的Fe3+、Cu2+、SO42-和少量Na+,先加过量铁(A),过滤,得到D溶液为FeSO4,C为Cu和多余的铁,再向C中加过量稀硫酸,过滤得到的Cu,E为FeSO4,硫酸亚铁经过蒸发浓缩、冷却结晶可以得到绿矾晶体,
①根据能和金属铁发生反应的物质来回答;
②试剂B是将金属铜和金属铁分离开的物质;
③操作③是从硫酸亚铁溶液中获得硫酸亚铁晶体,据此答题;
④用KSCN溶液可以检验溶液中是否有铁离子;
⑤亚铁离子易被空气中的氧气氧化;
⑥根据铁元素守恒可计算得硫酸亚铁晶体的物质的量.
解答 解:(1)根据溶液中电荷守恒可知,3c(Fe3+)+2c(Cu2+)+c(Na+)+c(H+)=2c(SO42-),所以c(H+)=(2×1×10-2-3×2×10-3-2×1×10-3-2×10-3)mol/L=0.01mol/L
故答案为:0.01;
(2)某工厂的工业废水中含有大量的Fe3+、Cu2+、SO42-和少量Na+,先加过量铁(A),过滤,得到D溶液为FeSO4,C为Cu和多余的铁,再向C中加过量稀硫酸,过滤得到的Cu,E为FeSO4,硫酸亚铁经过蒸发浓缩、冷却结晶可以得到绿矾晶体,
①酸性环境Fe3+、Cu2+、SO42-和少量Na+中,能和金属铁发生反应的物质是Fe3+、Cu2+、H+,发生的反应有:Fe+Cu2+═Fe2++Cu、Fe+2H+═Fe2++H2↑、2Fe3++Fe═3Fe2+,
故答案为:Fe+2Fe3+═3Fe2+; Fe+2H+═Fe2++H2↑;
②试剂B是将金属铜和金属铁分离开的物质,可以选择稀硫酸,
故答案为:H2SO4;
③从FeSO4溶液中提取溶质晶体采用蒸发浓缩、冷却结晶、过滤,最后用少量冷水洗涤晶体,在低温下干燥,防止变质,
故答案为:过滤;
④检验溶液D中Fe3+是否除尽的实验方法是 取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽,
故答案为:取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽;
⑤FeSO4有还原性,易被氧化(或FeSO4•7H2O失去结晶水),所以获得的FeSO4•7H2O需密闭保存,
故答案为:FeSO4有还原性,易被氧化(或FeSO4•7H2O失去结晶水);
⑥上述1000L废水中含有铁离子的物质的量为1000L×2×10-3mol/L=2mol,560g铁粉的物质的量为10mol,根据铁元素守恒可知,可获得 FeSO4•7H2O的物质的量为2mol+10mol=12mol,
故答案为:12.
点评 本题考查了工艺流程图的分析判断,解答本题要充分理解各种物质的性质,从而得出正确的结论,应熟悉混合物的分离方法,掌握过滤和蒸发结晶分离方法的使用条件及实验操作,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.5mol/L | B. | 3.0mol/L | C. | 2.0mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
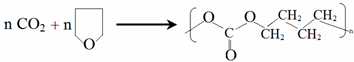
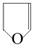
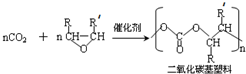 (-R、-R′代表烃基或氢原子)
(-R、-R′代表烃基或氢原子)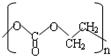 的单体是CO2和
的单体是CO2和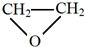 .
.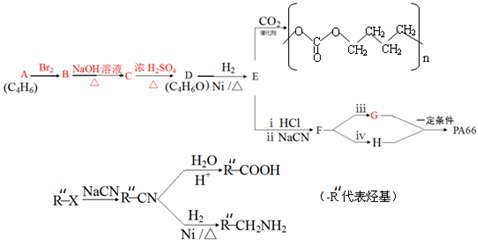
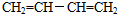 ,名称是1,3-丁二烯.
,名称是1,3-丁二烯.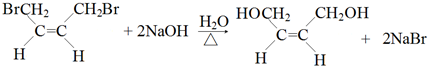 .
. .
. .
.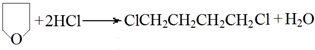 .
.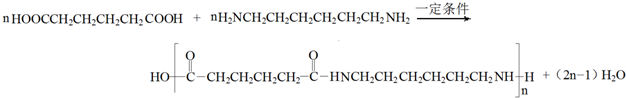 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,在烧瓶中加几粒沸石 | |
| B. | 加液时,胶头滴管悬置在试管正上方 | |
| C. | 萃取时,分液漏斗正立振荡后,直接放在铁架台上,静置 | |
| D. | 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 闻化学药品的气味时都不能使鼻子凑近药品 | |
| B. | 点燃氢气前要检查纯度,以免发生爆炸 | |
| C. | 在盛O2集气瓶中进行铁丝燃烧实验时,事先在集气瓶底铺上一层沙子 | |
| D. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
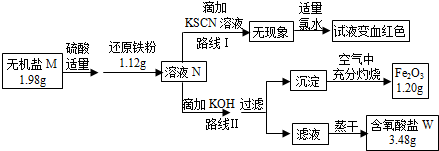
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2为原子晶体,CO2为分子晶体 | |
| B. | 中心原子采取的杂化方式:SO2为sp2杂化,CO2为sp杂化 | |
| C. | 都是直线形结构 | |
| D. | S原子和C原子上都没有孤电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com