
| A.ⅦA族元素是同周期中非金属性最强的元素 |
| B.第二周期ⅣA族元素的原子核电荷数和中子数分别为6 |
| C.主族元素的最高正价均等于其族序数 |
| D.非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:不详 题型:填空题
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | ③ | ④ | ⑤ | ⑥ | | ⑦ | ⑧ | ⑨ |
| 4 | ⑩ | ⑾ | | | | | ⑿ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2O2晶体中阴离子和阳离子 | B.NaHCO3晶体中的钠离子和碳酸氢根离子 |
C. 离子中的质子和中子 离子中的质子和中子 | D.氯化铵溶液中的铵根离子和氯离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
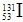 ),初步确认系来自日本核电站事故放射性物质的释放,但这些极微量的放射性物质对我国环境和公众健康不会产生影响,随后东部沿海地区也有类似发现。下列有关说法正确的是
),初步确认系来自日本核电站事故放射性物质的释放,但这些极微量的放射性物质对我国环境和公众健康不会产生影响,随后东部沿海地区也有类似发现。下列有关说法正确的是| A.碘-131是元素碘的一种同位素,正常情况下自然界是不会存在 |
| B.碘-131的化学性质与元素碘不同 |
| C.碘-131的原子核内有74个中子 |
| D.碘元素的相对原子质量是按照包括碘-131在内各种核素原子所占的一定百分比算出的平均值 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 0.102 | 0.037 |
| 最高或最低 化合价 | | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 |
| -2 | | | -3 | -1 | | -3 | | -2 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.②④ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 位置如下图所示,其中B元素形成的化合物在自然界中的种类最多。
位置如下图所示,其中B元素形成的化合物在自然界中的种类最多。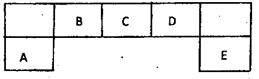

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com