
| A. | 非自发反应就是不可能发生的反应,自发反应就是能较快进行的反应 | |
| B. | 高温高压下可以使石墨转化为金刚石是自发的化学反应 | |
| C. | 由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 | |
| D. | 反应NH3(g)+HCl(g)═NH4Cl(s)在低温下能自发进行,说明该反应的△H>0 |
分析 A.自发进行的反应速率不一定较快;
B.石墨能量低于金刚石,在给定的条件下,无须外界做功,一经引发即能自动进行的化学反应为自发进行的反应;
C.复合判据△H-T•△S<0,反应能自发进行;
D.当△G=△H-T•△S<0时,反应能自发进行.
解答 解:A.反应能否自发进行与反应的速率大小无关,有些反应能自发进行,但反应速率很小,如金属的腐蚀,故A错误;
B.C(石墨)=C(金刚石),通常状况下△H>0,△S<0,反应是不自发的,而且将金刚石加热到1000℃可以变成石墨,故B错误;
C..△G=△H-T•△S<0时,反应能自发进行,适合于所有的过程,故C正确;
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,△G=△H-T•△S<0,•△S<0,则该反应的△H<0,故D错误;
故选C.
点评 本题考查了反应热与焓变的应用,题目难度中等,明确判断反应能否自发进行的方法为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:填空题
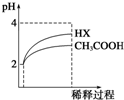 25℃时,电离平衡常数:CH3COOH:1.8×10-5 H2CO3::K1 4.3×10-7
25℃时,电离平衡常数:CH3COOH:1.8×10-5 H2CO3::K1 4.3×10-7查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 煤是由有机物和无机物组成的复杂混合物 | |
| D. | 石油含有C5~C11的烷烃,可以通过石油的分馏得汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若(a)池消耗2.24LH2,则(b)池(C1)极产生0.2mol CO2 | |
| B. | (a)池燃料电池中正极反应式为O2+4e-+4H+═2H2O | |
| C. | 将(b)池电解后的溶液加热蒸干,得到NaOH固体 | |
| D. | (b)池右侧石墨电极(C2)为电解池阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
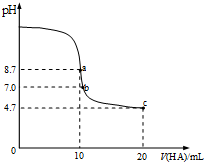
| A. | a点所示溶液中:c(Na+)>c(A-)>c(HA)>c(OH-) | |
| B. | a~b段溶液中:c(Na+)+c(H+)=c(A-)+c(OH-) | |
| C. | pH=7时的溶液中:c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中:c(HA)>c(Na+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Va>Vb时:c (CH3COOH)>c (CH3COO-)>c (K+) | |
| B. | Va=Vb时:c (CH3COOH)+c (H+)>c (OH-) | |
| C. | Va<Vb时:c (CH3COO-)>c (K+)>c (OH-)>c (H+) | |
| D. | Va与Vb任意比时:c (K+)+c (H+)=c (OH-)+c (CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1 AgNO3溶液 | 现象a出现白色沉淀,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1 KI溶液 | 出现黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H4 | C. | C2H6 | D. | C2H6O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com