
| 选项 | 项目 | 分析 |
| A | 制备乙烯、制备硝基苯 | 实验时均用到了温度计 |
| B | 乙烯制备乙醇、氯乙烷制备乙醇 | 属于同一反应类型 |
| C | 丙烯可以使溴水和酸性高锰酸钾溶液褪色 | 褪色原理不同 |
| D | 乙醇燃烧、乙醇使重铬酸钾变色 | 均为氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.制备乙烯需要控制温度在170℃,制备硝基苯需要将温度控制在50~60℃;
B.乙烯制备乙醇为加成反应、氯乙烷制备乙醇为取代反应;
C.丙烯与溴水发生加成反应,丙烯与酸性高锰酸钾溶液发生氧化还原反应;
D.乙醇燃烧和乙醇使重铬酸钾变色的反应都是氧化还原反应.
解答 解:A.在浓硫酸作用下迅速加热到170℃,乙醇脱水生成乙烯;制备硝基苯的反应温度为50~60℃,所以两个实验都需要温度计,故A正确;
B.乙烯与水发生加成反应生成乙醇,氯乙烷在氢氧化钠的水溶液中发生水解反应生成乙醇,两个反应类型不同,故B错误;
C.丙烯可以使溴水和酸性高锰酸钾溶液褪色,前者为加成反应,后者为氧化还原反应,褪色原理不同,故C正确;
D.乙醇与氧气燃烧生成二氧化碳和水,重铬酸钾具有强氧化性,能够氧化乙醇,两个反应都属于氧化还原反应,故D正确;
故选B.
点评 本题考查实验方案的评价,题目难度中等,涉及反应类型判断、氧化还原反应、有机物制备原理等知识,明确常见有机物组成、结构与性质为解答关键,试题培养l学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| 描述一 | 描述二 | |
| A | 淀粉和纤维素互为同分异构体 | 乙酸和乙酸乙酯互为同系物 |
| B | 金刚石和石墨互为同素异形体 | O2和O3互为同位素 |
| C | SO2和NO2都属于大气污染物 | pH小于7的雨水就属于酸雨 |
| D | 正反应活化能小于逆反应活化能的反应属于放热反应 | 反应物能量总和大于生成物能量总和的反应属于放热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③④ | C. | ①②③⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
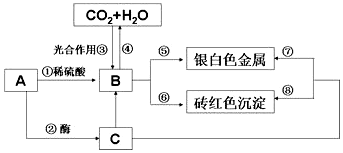
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | m+n>p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率减小 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com