
| A. | 变小 | B. | 变大 | C. | 不变 | D. | 无法确定 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
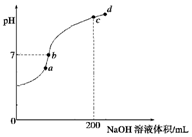 已知,常温下H2S、H2CO3的电离常数如表
已知,常温下H2S、H2CO3的电离常数如表| Ka1 | Ka2 | |
| H2S | 9.1×10-8 | 1×10-15 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
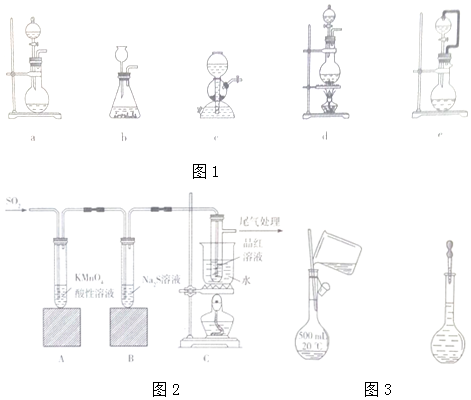
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | Cl2和NaCl中均含有氯元素,它们的化学性质相同 | |
| C. | 实验室制备Cl2可用排饱和食盐水集气法收集 | |
| D. | 氯气、液氯和氯水是一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发现放射性元素钋和镭 | B. | 现代量子化学的创立 | ||
| C. | 人工全合成牛胰岛素 | D. | 元素周期律的发现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分类是学习和研究化学物质及其变化的一种常用方法 | |
| B. | 有些液态胶体也是透明的,用肉眼很难与溶液相区别 | |
| C. | 2 L1 mol/L Na2 CO3溶液中c(Na+)为4 mol/L | |
| D. | 从1 LNaCl溶液中取出100 ml,其浓度与原1L溶液相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
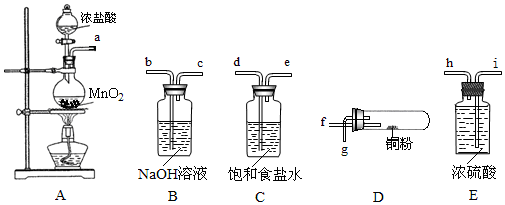
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com