
| A. | 生成白色沉淀、有气泡产生 | B. | 生成红褐色沉淀、有气泡产生 | ||
| C. | 生成黑色沉淀,有气泡产生 | D. | 无明显现象 |
科目:高中化学 来源: 题型:选择题
| A. | 150mL1mol/L的氯化钠溶液 | B. | 75mL2mol/L的氯化铵溶液 | ||
| C. | 150mL3mol/L的氯化钾溶液 | D. | 75mL1mol/L的氯化亚铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答:
如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | |
| A | 无明显现象 | 只有AgBr沉淀生成 |
| B | 生成淡黄色沉淀 | AgCl和AgBr沉淀都有,但AgCl沉淀更多 |
| C | 无明显现象 | AgCl和AgBr沉淀都有,但AgCl沉淀更多 |
| D | 生成黄色沉淀 | AgCl和AgBr沉淀都有,但AgBr沉淀更多 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1mol氨充分溶解在1L水中 | |
| B. | 将10g质量分数为98%的硫酸与990g水混合 | |
| C. | 将10mL•1mol•L-1的盐酸与90mL水充分混合 | |
| D. | 将25.0g胆矾(CuSO4•5H2O)溶于水配成1L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
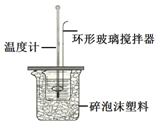 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| HCl | NaOH | ||
| 1 | 26.1 | 26.1 | 29.3 |
| 2 | 25.9 | 25.9 | 29.0 |
| 3 | 26.3 | 26.3 | 29.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 酸 | HClO2 | H2CO3 | HClO |
| Ka | 1×10-2 | K1=4.3×10-7、K2=5.6×10-11 | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl可用作食品调味剂 | |
| B. | 相同温度下NaHCO3溶解度大于Na2CO3 | |
| C. | Na2CO3的焰色反应呈黄色 | |
| D. | 工业上Na可用于制备钛、锆等金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com