
原子序数由小到大排列的四种短周期元素X、Y、 Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。 M元素与X同主族,与W同周期。
(1)M元素是__________(填元素符号)。
(2)Z、W形成的气态氢物的稳定性为_______>________。(填化学式)
(3)写出M2Z2的电子式_________,写出M2Z2与水反应的离子方程式__________。
(4)由X、Y、Z、W四种元素中的三种组成的—种强酸,该强酸的稀溶液能与铜反应,离子方程式为
__________________________________。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是__________
(填化学式).写出该气体B与氯水反应的离子方程式__________________________________________。(6)由X、Y、 Z、W和Fe五种元素组成的相对分子质量为392的化合物C,1mol C中含有6mol结晶水。对化合物C进行下实验:
a.取C的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取C的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①写出C的化学式为_______________________________________。
②试写出C与M2Z2按物质的量比1:2在溶液中反应的化学方程式____________________________。
【答案】(18分)(1)Na(1分) (2)H2O(2分);H2S(2分)
(3)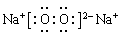 (2分);2Na2O2+2H2O=4Na++4OH-+O2↑(2分)
(2分);2Na2O2+2H2O=4Na++4OH-+O2↑(2分)
(4)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O(2分)
(5)(NH4)2SO3(1分);SO2+Cl2+2H2O=SO42-+2Cl-+4H+(2分)
(6)①(NH4)2Fe(SO4)2·6H2O(2分)
 ②4(NH4)2Fe(SO4)2·6H2O+8 Na2O2=4Fe(OH)3+8NH3+3O2↑+8Na2SO4+22H2O(2分)
②4(NH4)2Fe(SO4)2·6H2O+8 Na2O2=4Fe(OH)3+8NH3+3O2↑+8Na2SO4+22H2O(2分)
(3)过氧化钠是由钠离子与过氧根离子构成的离子化合物,则其电子式为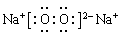 ;过氧化钠与水反应生成氢氧化钠与氧气,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
;过氧化钠与水反应生成氢氧化钠与氧气,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
(4)由H、N、O、S中的三种元素组成的一种强酸是硝酸或硫酸。由于该强酸的稀溶液能与铜反应,因此该强酸应该是硝酸。硝酸具有强氧化性,与铜反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O。

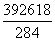 =1,所以该化合物的化学式为(NH4)2Fe(SO4)2·6H2O。
=1,所以该化合物的化学式为(NH4)2Fe(SO4)2·6H2O。
②过氧化钠溶于水生成氧气与氢氧化钠,氧气具有氧化性,能把生成的氢氧化亚铁氧化生成氢氧化铁。所以C与M2Z2按物质的量比1:2在溶液中反应的化学方程式为4(NH4)2Fe(SO4)2·6H2O+8 Na2O2=4Fe(OH)3+8NH3+3O2↑+8Na2SO4+22H2O。
考点:考查元素与物质推断、元素周期律的应用、电子式、氧化还原反应方程式的书写


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列叙述正确的是
A.标准状况下,1.12 L16O2和1.12 L18O2均含有0.1NA个氧原子
B.第三周期非金属元素含氧酸的酸性从左到右依次增强
C.能使甲基橙显红色的溶液中大量存在:Mg2+、Fe2+、Cl—、NO—3
D.从C(石墨)===C(金刚石);ΔH=+1.9 kJ·mol-1,可知金刚石比石墨更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
月球表面土壤里的—种非常有用的资源——可控核聚变的原料,关于的叙述正确的是
A. 3He和4He是同种原子
B.3He和4He互为同位素
C.核聚变时,原子核发生了变化,发生了化学反应
D.在3He中存在:质子数=中子数=核外电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿伏加德罗常数,下列说法正确的是
A.含有NA个氖原子的氖气在标准状况下的体积约为11.2L
B.2.3gNa被O2完全氧化时,失去电子数为0.1NA
C.2Llmol/L的盐酸中所含氯化氢分子数约为2NA
D.标准状况下,5.6LCCl4含有的分子数为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列比较中,正确的是
A.同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF>NaCN
B.物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1mol/L的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小
D.体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等量的锌粉,前者用时长
查看答案和解析>>
科目:高中化学 来源: 题型:
有0.1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
A.溶液①中,c(CH3COO-)= c(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- )
C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+)
D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末, C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。回答下列问题:
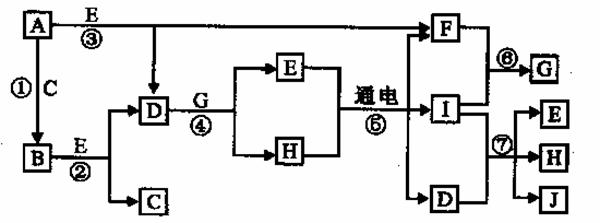
(1)B中阴离子的电子式为 ,与E组成元素相同的化合物的结构式为 。
(2)已知D与G反应生成ImolE放出的热量为aKJ,请写出表示D与H2SO4中和热的热化学方程式 。
(3)向FeCl2溶液中加入大量固体B,写出反应离子方程式 。
(4)常温下以Pt为电极电解滴加有少量酚酞的H饱和溶液2L,则在 (填“阴或阳”)极附近溶液由无色变为红色,若用F、C组成电池(熔融K2CO3做电解质)供电,电池的负极反应式为 ,正极反应式为 ,电解过程中,忽略溶液体积变化,则当溶液的PH=13时,负极消耗气体的体积在标况下为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组表述中,两个微粒不属于同种元素原子的是:
A.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p64s2的原子
B.3p能级有一个空轨道的基态原子和核外电子的排布为1s22s22p63s23p2的原子
C.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布为2s22p5的原子
D.最外层电子数是核外电子总数的1/5的原子和最外层电子排布为4s24p5的原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com