
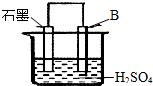
£Ø14·Ö£©£Ø¢ń£©A”¢B”¢CČżÖÖĪŽÉ«æÉČÜŠŌŃĪ·Ö±šŹĒÓÉNa+”¢Ag+ ”¢Ba2+”¢Cl”Ŗ”¢NO3”Ŗ ”¢CO32”ŖÖŠ²»Ķ¬µÄŅõ”¢ŃōĄė×ÓĖł×é³É”£¾ŹµŃéAČÜŅŗ”¢BČÜŅŗ¾łæÉŅŌÓėŃĪĖį·“Ó¦£¬ĘäÖŠA²śÉś°×É«³Įµķ£¬B²śÉśĘųÅŻ”£ŌņAĪŖ ”¢BĪŖ ”£½«BŗĶCµÄČÜŅŗ»ģŗĻ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ ”£
£Ø¢ņ£©ÓŠŅ»°ü¹ĢĢå·ŪÄ©£¬ÓÉCaCO3”¢Na2SO4”¢KNO3”¢BaCl2”¢CuSO4ÖŠµÄČżÖÖĪļÖŹ×é³É£¬Č”ѳʷ½ųŠŠČēĻĀŹµŃé£ŗ
“ÓŹµŃéæÉŅŌÅŠ¶Ļ£¬øĆ¹ĢĢå·ŪÄ©ÖŠŅ»¶Ø²»ŗ¬ÓŠ £¬
ĖüµÄ×é³ÉæÉÄÜŹĒ »ņ ”£
£Ø14·Ö£©£Ø¢ń£© AgNO3 Na2CO3 BaCl2+Na2CO3=BaCO3 ”ż+2NaCl
£Ø¢ņ£©CuSO4 CaCO3”¢Na2SO4”¢KNO3 CaCO3”¢KNO3”¢BaCl2
½āĪöŹŌĢā·ÖĪö£ŗ£Ø¢ń£©BČÜŅŗ²śÉśĘųÅŻ£¬ĖłŅŌBÖŠŗ¬ÓŠCO32££¬ĖłŅŌBŹĒĢ¼ĖįÄĘ£»AČÜŅŗ²śÉś°×É«³Įµķ£¬ĖłŅŌAÖŠŗ¬ÓŠŅųĄė×Ó£¬ŌņAÓ¦øĆŹĒĻõĖįŅų£¬ĖłŅŌCŹĒŃõ»Æ±µ”£ŌņBŗĶC·“Ó¦µÄ·½³ĢŹ½ŹĒBaCl2+Na2CO3=BaCO3 ”ż+2NaCl”£
£Ø¢ņ£©¹ĢĢåČÜÓŚĖ®ŹĒĪŽÉ«ČÜŅŗŗĶ°×É«³Įµķ£¬ĖłŅŌŅ»¶ØƻӊĮņĖįĶ£»ÓÉÓŚ°×É«³ĮµķÄÜČÜÓŚŃĪĖįÖŠÉś³ÉĪŽÉ«ĘųĢåŗĶĪŽÉ«ČÜŅŗ£¬ĖłŅŌ°×É«³Įµķ²»ŹĒĮņĖį±µ£¬¶ųŹĒĢ¼ĖįøĘ£¬¶ųĮņĖįÄĘŗĶĀČ»Æ±µ²»ÄÜĶ¬Ź±“ęŌŚ£¬ÓÉÓŚøĆĪļÖŹŹĒÓÉČżÖÖĪļÖŹ×é³ÉµÄ£¬ŹĒÓÉĘäĘš×é³ÉæÉÄÜŹĒCaCO3”¢Na2SO4”¢KNO3 ”¢CaCO3”¢KNO3”¢BaCl2”£
æ¼µć£ŗæ¼²éĄė×ӵĹ²“ę¼°Ąė×ÓµÄÓŠ¹Ų¼ģŃéµČ
µćĘĄ£ŗ½ųŠŠĪļÖŹµÄ¼ģŃ鏱£¬ŅŖŅĄ¾ŻĪļÖŹµÄĢŲŹāŠŌÖŹŗĶĢŲÕ÷·“Ó¦£¬Ń”ŌńŹŹµ±µÄŹŌ¼ĮŗĶ·½·Ø£¬×¼Č·¹Ū²ģ·“Ó¦ÖŠµÄĆ÷ĻŌĻÖĻó£¬ČēŃÕÉ«µÄ±ä»Æ”¢³ĮµķµÄÉś³ÉŗĶČܽā”¢ĘųĢåµÄ²śÉśŗĶĘųĪ¶”¢»šŃęµÄŃÕÉ«µČ£¬½ųŠŠÅŠ¶Ļ”¢ĶĘĄķ”¢ŃéÖ¤¼“æÉ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| 3 | 4 |


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

 +2Cu£ØOH£©2
+2Cu£ØOH£©2 C6H5-CH=CH-COOH+Cu2O”ż+2H2O
C6H5-CH=CH-COOH+Cu2O”ż+2H2O +2Cu£ØOH£©2
+2Cu£ØOH£©2 C6H5-CH=CH-COOH+Cu2O”ż+2H2O
C6H5-CH=CH-COOH+Cu2O”ż+2H2O

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ŃōĄė×Ó | Na+”¢K+”¢Cu2+ |
| ŅõĄė×Ó | SO42-”¢OH- |

| ||
| ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
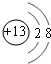
 ĻÖÓŠA”¢B”¢CČżÖÖ¶ĢÖÜĘŚŌŖĖŲ£¬Ō×ÓŠņŹżŅĄ“ĪµŻŌö£®AÓėCµÄÖŹ×ÓŹżÖ®ŗĶĪŖ27£¬×īĶā²ćµē×ÓŹżÖ®²īĪŖ5£»0.9gµ„ÖŹBÓė×ćĮæŃĪĖį·“Ó¦£¬ŹÕ¼Æµ½ĘųĢå1.12L£Ø±ź×¼×“æö£©£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
ĻÖÓŠA”¢B”¢CČżÖÖ¶ĢÖÜĘŚŌŖĖŲ£¬Ō×ÓŠņŹżŅĄ“ĪµŻŌö£®AÓėCµÄÖŹ×ÓŹżÖ®ŗĶĪŖ27£¬×īĶā²ćµē×ÓŹżÖ®²īĪŖ5£»0.9gµ„ÖŹBÓė×ćĮæŃĪĖį·“Ó¦£¬ŹÕ¼Æµ½ĘųĢå1.12L£Ø±ź×¼×“æö£©£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

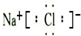
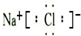
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com