
����Ŀ��������̼�IJ����������������ҹ���Դ�����һ����Ҫս�Է���չ��һ����Ҫ�����˲�ҵ��
��1����֪��CH4��CO��H2��ȼ���ȷֱ�Ϊ890kJ��mol-1��283kJ��mol-1��285.5kJ��mol-1���������з�Ӧ�ķ�Ӧ�ȣ�CO2(g)+CH4(g)=2CO(g)+2H2(g) ��H��___kJ��mol-1��
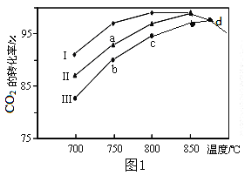
��2�����÷����е�CO2Ϊԭ����ȡ�״�����Ӧ����ʽΪ��CO2+3H2![]() CH3OH+H2O����������ͬ���ü״��ϳɷ�Ӧ�ڲ�ͬ������I��II��III�������·�Ӧ��ͬʱ���CO2��ת�����淴Ӧ�¶ȵı仯��ͼ1��ʾ��
CH3OH+H2O����������ͬ���ü״��ϳɷ�Ӧ�ڲ�ͬ������I��II��III�������·�Ӧ��ͬʱ���CO2��ת�����淴Ӧ�¶ȵı仯��ͼ1��ʾ��
�ٸ÷�Ӧ�ġ�H__0����������������������
��d�㲻ͬ������I��II��III��������CO2��ת������ͬ��ԭ����___��
��3���ö�����̼���������ϳɵ�̼ϩ������ʼʱ��0.1MPa��n(H2)��n(CO2)=3��1��Ͷ�ϱȳ��뷴Ӧ���У�������Ӧ��2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ��H����ͬ�¶���ƽ��ʱ��������̬���ʵ����ʵ�����ͼ2��ʾ��
C2H4(g)+4H2O(g) ��H����ͬ�¶���ƽ��ʱ��������̬���ʵ����ʵ�����ͼ2��ʾ��
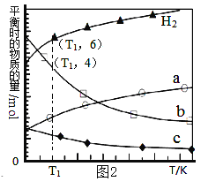
�ٸ÷�Ӧ��___�Է����У�������������������������
��b������������___��
��T1�¶��µ�ƽ��ת����Ϊ___��
���𰸡�+247.6 < d����ﵽƽ��״̬��������Ӱ��ƽ��ת���� ���� H2O 50%
��������
��1����������õ�����![]() ��
��
��![]() ��
��
��![]() ��
��
�ɸ�˹���ɢ�-����2-����2�õ���![]()
![]() =+247.6kJ/mol��
=+247.6kJ/mol��
�ʴ�Ϊ��+247.6��
��2����ͼ����Կ��������ŷ�Ӧ�Ľ��У��¶������ߣ�CO2ת�����������ߣ�Ȼ�����½���˵����Ӧ![]() Ϊ���ȷ�Ӧ�����ת������ȣ���ԭ����d���Ƿ�Ӧ���Ѵﵽ��ƽ��״̬���Ҵ�����Ӱ��ƽ���ƶ���
Ϊ���ȷ�Ӧ�����ת������ȣ���ԭ����d���Ƿ�Ӧ���Ѵﵽ��ƽ��״̬���Ҵ�����Ӱ��ƽ���ƶ���
�ʴ�Ϊ��<��d����ﵽƽ��״̬��������Ӱ��ƽ��ת���ʣ�
��3����.����ͼʾ���߿�֪���¶������������ʵ�������ƽ�����ƣ�˵������ӦΪ���ȷ�Ӧ��![]() <0������Ӧ���Ҷȼ�С����
<0������Ӧ���Ҷȼ�С����![]() <0�����Ը���
<0�����Ը���![]() ��˵����Ӧ�ܹ��Է����У���Ҫ�ڽϵ��������Է����У�
��˵����Ӧ�ܹ��Է����У���Ҫ�ڽϵ��������Է����У�
�ʴ�Ϊ�����£�
��.�������������ʵ����仯��˵��a��CO2������b��cΪ��ϩ��ˮ������������ϩ��ˮ�����ĸı���֮��Ϊ1:4������bΪH2O��
�ʴ�Ϊ��H2O��
��.T1�¶���aΪ2mol����ϩ(c)Ϊ1mol������Ϊ6mol��ˮ����Ϊ4mol��˵����Ӧ������Ϊ6mol������T1�¶���ƽ��ת����Ϊ��![]() =50%��
=50%��
�ʴ�Ϊ��50%��


 �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д� ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������±ʯ��K2SO4MgSO42CaSO42H2O������������������ˮ�д�������ƽ��
K2SO4MgSO42CaSO42H2O��s��2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
Ϊ�ܳ�����ü���Դ���ñ���Ca��OH��2��Һ�ܽ���±ʯ�Ʊ�����أ�����������ͼ1��
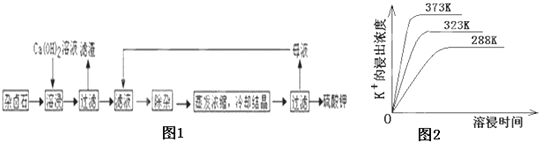
��1��������Ҫ�ɷ���__________��___________�Լ�δ����±ʯ��
��2���û�ѧƽ���ƶ�ԭ������Ca��OH��2��Һ���ܽ���±ʯ����K+��ԭ��_______________��
��3���������������У��ȼ���_______��Һ��������Ȳ������ˣ��ټ���________��Һ����ҺPH�����ԣ�
��4����ͬ�¶��£�K+�Ľ���Ũ�����ܽ�ʱ��Ĺ�ϵ��ͼ2����ͼ�ɵã������¶����ߣ���__________________________��______________________________��
��5�������Կ�����̼����Ϊ�ܽ��������ܽ������лᷢ����CaSO4��s��+![]() CaCO3��s��+
CaCO3��s��+![]()
��֪298Kʱ��Ksp��CaCO3��=2.80��10��9��Ksp��CaSO4��=4.90��10��5������¶��¸÷�Ӧ��ƽ�ⳣ��K_____________��������������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���Ǻϳ���һ�������ʡ��������飬�����ʽ��ͼ��ʾ�������й��������˵����ȷ����(����)

A. �����������黥Ϊͬϵ�� B. ������Ļ�ѧʽΪC15H20
C. ������ķ����к���7����Ԫ�� D. �������һ�ȴ�����3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�ѧ�����������ȷ���ǣ� ��
A.����ģ��![]() �ȿ��Ա�ʾ������ӣ�Ҳ���Ա�ʾ���Ȼ�̼����
�ȿ��Ա�ʾ������ӣ�Ҳ���Ա�ʾ���Ȼ�̼����
B.����ʽ![]() H�ȿ��Ա�ʾ�ǻ���Ҳ���Ա�ʾ����������
H�ȿ��Ա�ʾ�ǻ���Ҳ���Ա�ʾ����������
C.��ϩ�����ʽ�ɱ�ʾΪCH2
D.�ṹ��ʽ(CH3)2CHCH3�ȿ��Ա�ʾ�����飬Ҳ���Ա�ʾ�춡��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuCl����ʰ�ɫ���۵�Ϊ430�����е�Ϊ1490��������ֽ⣬¶���ڳ�ʪ�������ױ�������������ˮ��ϡ���ᡢ�Ҵ���������Ũ��������H3CuCl4����Ӧ�Ļ�ѧ����ʽΪCuCl��s��+3HCl��aq��H3CuCl4��aq����
��1��ʵ��������ͼ1��ʾװ����ȡCuCl����Ӧԭ��Ϊ��
2Cu2++SO2+8Cl��+2H2O�T2CuCl43��+SO![]() +4H+
+4H+
CuCl43����aq��CuCl��s��+3Cl����aq��
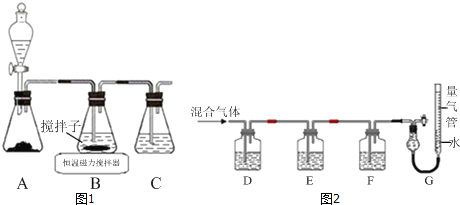
��װ��C��������_____��
��װ��B�з�Ӧ������ȡ������������ͼ��ʾ�������õ�CuCl���壮
�����![]()
![]()
![]()
![]()
![]() CuCl����
CuCl����
����������ҪĿ����_____
�����������ѡ�õ��Լ���_____��
��ʵ���ұ�������CuCl����ķ�����_____��
�����ᴿij����ͭ�۵�CuCl���壬�����ʵ�鷽����_____��
��2��ijͬѧ������ͼ2��ʾװ�ã��ⶨ��¯ú����CO��CO2��N2��O2�İٷ���ɣ�
��֪��
i��CuCl��������Һ������CO�γ�Cu��CO��ClH2O��
ii�����շۣ�Na2S2O4����KOH�Ļ����Һ������������
��D��Fϴ��ƿ����ʢ�ŵ��Լ��ֱ���_____��_____��
��д�����շۺ�KOH�Ļ����Һ����O2�����ӷ���ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�ѧ�����������ȷ���ǣ� ��
A.����ģ��![]() �ȿ��Ա�ʾ������ӣ�Ҳ���Ա�ʾ���Ȼ�̼����
�ȿ��Ա�ʾ������ӣ�Ҳ���Ա�ʾ���Ȼ�̼����
B.����ʽ![]() H�ȿ��Ա�ʾ�ǻ���Ҳ���Ա�ʾ����������
H�ȿ��Ա�ʾ�ǻ���Ҳ���Ա�ʾ����������
C.��ϩ�����ʽ�ɱ�ʾΪCH2
D.�ṹ��ʽ(CH3)2CHCH3�ȿ��Ա�ʾ�����飬Ҳ���Ա�ʾ�춡��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
1.����ƽF�ǽ�Ѫ֬�������̴���ҩ�����һ���ϳ�·�����£�

��1��AΪһԪ���ᣬ8.8g A������NaHCO3��Һ��Ӧ����2.24L CO2����״������A�ķ���ʽΪ_____________________________________________��
��2��д������A����ʽ�����м������Ľṹ��ʽ��_____________________��
��3��B���ȴ����ᣬ��˴Ź��������������壬д��B![]() C�ķ�Ӧ����ʽ��
C�ķ�Ӧ����ʽ��
__________________________________________________________��
��4��C+E![]() F�ķ�Ӧ����Ϊ________________________��
F�ķ�Ӧ����Ϊ________________________��
��5��д��A��F�Ľṹ��ʽ��
A______________________�� F__________________________��
��6��D�ı������������⣬�����������ŵ�����Ϊ___________________��д��a��b���������Լ���a ______________��b___________��
��.������·�ߣ���C�ɺϳɸ߾���H��
![]()
��7��C![]() G�ķ�Ӧ����Ϊ_____________________��
G�ķ�Ӧ����Ϊ_____________________��
��8��д��G![]() H�ķ�Ӧ����ʽ��_______________________��
H�ķ�Ӧ����ʽ��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��C(s) + H2O(g) =CO(g) + H2(g)�� ��H��a kJ��mol-1
2C(s) +O2(g) =2CO(g)�� ��H����220 kJ��mol-1
H-H��O��O��O-H���ļ��ֱܷ�Ϊ436 kJ��mol-1��496 kJ��mol-1��462 kJ��mol-1����aΪ( )
A.+332B.+118C.+350D.+130
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NO��CO���������ŷ�β���е��к����ʣ���Ҫ��һ�����������á�
(1)��֪��CO�ɽ����ֵ��������ﻹԭΪN2��
��Ӧ��2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
��Ӧ��4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
д��CO��NO2��ԭΪNO���Ȼ�ѧ����ʽ__________________��
(2)���ܱ������г���5 mol CO��4 mol NO������������ӦI����ͼΪƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ��

�ش��������⣺
���¶ȣ�T1_________T2(����������������)��
��ij�¶��£������Ϊ2 L���ܱ������У���Ӧ����10���ӷų�����373 kJ����CO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(CO)=_____________��ͼ��A~G���У�����Ӧ����������______��(�����)
��ij�¶��£���Ӧ�ﵽƽ��״̬D��ʱ���������Ϊ2 L����ʱ��ƽ�ⳣ��K =_____(�����ȷ��0.01)��
(3)��ҵ�Ͽ�������CO��H2��Ӧ�ϳɼ״���CO(g)+2H2(g)![]() CH3OH(g) ��H�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ��ʱ���й��������±���
CH3OH(g) ��H�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ��ʱ���й��������±���
���� | ��Ӧ��Ͷ���� | ��Ӧ���ת���� | CH3OH��Ũ��(mol/L) | �����仯(Q1��Q2��Q3������0) |
1 | 1molCO��2molH2 | a1% | c1 | �ų�Q1KJ���� |
2 | 1molCH3OH | a2% | c2 | ����Q2KJ���� |
3 | 2molCO��4molH2 | a3% | c3 | �ų�Q3KJ���� |
�ٸ÷�Ӧ����HΪ_________��(�ô�Q1��Q2��Q3��ʽ�ӱ�ʾ)
�����й�ϵһ����ȷ������______��
A. c1= c2 B. a1 >a3 C.a1=a2 D. 2Q1 < Q3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com