
下列说法不正确的是( )
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS在一定条件下可转化为CuS
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质作比较时,Ksp越小的电解质,其溶解度一定越小
科目:高中化学 来源: 题型:
Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg===Mg2++2Ag+2Cl-
试书写该电池的正、负极电极反应式。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分类正确的是( )
A.共价化合物——硫酸、纯碱、水
B.分散系——空气、水玻璃、盐酸
C.非电解质——液氯、乙醇、NH3
D.强氧化剂——盐酸、硫酸、硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
根据题目提供的溶度积数据进行计算并回答下列问题:
(1)已知25 ℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25 ℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________。
(2)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________。
②完全沉淀后,溶液的pH=__________。
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成?____________(填“是”或“否”)。
(3)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

| 模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;
实验过程中,假设溶液体积不变。
Ksp(CaCO3)=4.96×10-9
Ksp(MgCO3)=6.82×10-6
Ksp[Ca(OH)2]=4.68×10-6
Ksp[Mg(OH)2]=5.61×10-12
下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
实验:①0.1 mol·L-1MgCl2溶液和0.2 mol·L-1NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;②向浊液a中滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀。下列分析不正确的是( )
A滤液b的pH=7
B.②中颜色变化说明Mg(OH)2转化为Fe(OH)3
C.实验可以证明Fe(OH)3的溶解度比Mg(OH)2的小
D.浊液a中存在沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如下图所示。
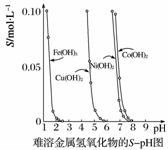
(1)pH=3时溶液中铜元素的主要存在形式是________(写化学式)。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为______(填字母)。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________________________________。
(4)已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的________除去它们(填字母)。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
现代科技的高度快速发展离不开C和Si元素。
(1)写出Si的基态原子核外电子排布式__________________。
(2)从电负性角度分析,C、Si、O元素的非金属活泼性由强至弱的顺序为______。
(3)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为_____,微粒间存在的作用力是_______。
(4)C、Si为同一主族的元素,CO2 、SiO2的化学式相似,但结构和性质有很大的不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成上述π键,而Si、O原子间不能形成上述π键:_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
①参加反应的物质的性质是影响化学反应速率的主要因素
②光是影响某些化学反应速率的外界条件之一 ③决定化学反应速率的主要因素是浓度 ④不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com