
| A、2NH3(g)?3H2(g)+N2(g);△H>0 |
| B、3O2(g)?2O3(g);△H>0 |
| C、H2(g)+I2(g)?2HI(g);△H<0 |
| D、2NO2(g)?N2O4(g);△H<0 |
科目:高中化学 来源: 题型:
| 1 |
| 2 |
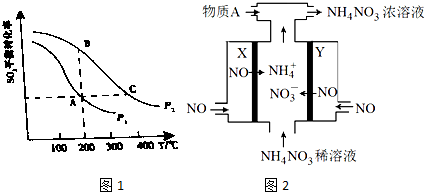
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以常量共存 |
| B、在pH=0的溶液中,Na+、NO3-、SO32-、K+可以常量共存 |
| C、0.1mol/L一元碱BOH溶液的pH=10,可推知BOH溶液中存在BOH=B++OH- |
| D、在0.1mol/L一元酸HA溶液的pH=3,可推知NaA溶液中存在:A-+H2O?HA+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、卤素单质与水反应均可用X2+H2O═HXO+HX表示 |
| B、从F2到I2,卤素单质的颜色随着相对分子质量的增大而加深 |
| C、熔、沸点:Li>Na>K |
| D、还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4℃时,纯水的pH=7 |
| B、温度升高,纯水中的c(H+)增大,c(OH-)减小 |
| C、水的电离程度很小,纯水中主要存在形态是水分子 |
| D、向水中加入酸或碱,都可抑制水的电离,使水的离子积减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食盐和蔗糖溶于水 |
| B、氯化钠和硫熔化 |
| C、碘和干冰升华 |
| D、二氧化硅和氧化钠熔化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com