
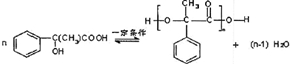
 ,G的一种同分异构体的结构简式为
,G的一种同分异构体的结构简式为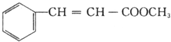 .
.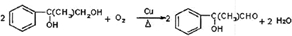
 .
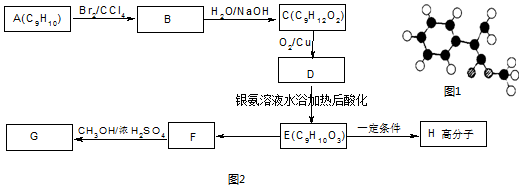
. 分析 由结构模型可知G为 ,则F为
,则F为 ,根据碳链结构可知A为
,根据碳链结构可知A为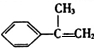 ,B为
,B为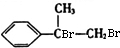 ,C为
,C为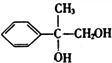 ,D为
,D为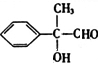 ,E为
,E为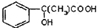 ,H为
,H为 ,结合有机物的结构和性质解答该题.
,结合有机物的结构和性质解答该题.
解答 解:(1)根据以上分析,由结构模型可知G为 ,G的一种同分异构体的结构简式为
,G的一种同分异构体的结构简式为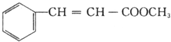 ,
,
故答案为: ;
;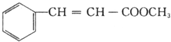 ;
;
(2)E为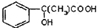 ,含有的官能团为羟基、羧基,故答案为:羟基、羧基;
,含有的官能团为羟基、羧基,故答案为:羟基、羧基;
(3)A为 ,B为
,B为 ,A发生加成反应生成B,所以其反应类型是加成反应;
,A发生加成反应生成B,所以其反应类型是加成反应;
E为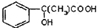 ,F为
,F为 ,E发生消去反应生成F,所以其反应类型是消去反应;
,E发生消去反应生成F,所以其反应类型是消去反应;
故答案为:加成反应;消去反应;
(4)C为 ,D为
,D为 ,E为
,E为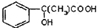 ,H为
,H为 ,
,
则C→D的方程式为: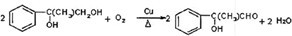
E→H的方程式为: ;
;
故答案为: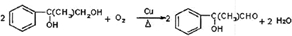 ;
; .
.
点评 本题考查有机物的推断,题目难度中等,本题侧重于有机物的结构、性质的考查,注意根据有机物结构模型判断G的结构,为解答该题的关键,要特别注重有机物官能团性质的把握.


科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制备氨气 | 将浓氨水逐滴滴入CaO固体中 |
| B | 制备氯气 | 将浓盐酸逐滴滴入浓硫酸 |
| C | 制备氧气 | 向双氧水中滴入ZnSO4溶液 |
| D | 制备氢气 | 酒精灯加热碳与水的混合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 气体的总物质的量 | |
| D. | 单位时间内生成nmolC的同时消耗2nmolB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:F->Mg2+>Al3+ | B. | 热稳定性:HCl>H2S>AsH3 | ||
| C. | 酸性:H3AlO3<H2CO3<H3PO4 | D. | 水溶性:SO2<H2S<NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷单质及其化合物有广泛应用.
磷单质及其化合物有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 | |
| B. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| C. | 实验中需用2.0 mol•L-1的Na2 CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950mL,201.4g | |
| D. | 减压过滤的原理是抽气泵给吸滤瓶减压,造成吸滤瓶内与布氏漏斗液面上的压力差,从而加快过滤速度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
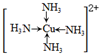 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com