
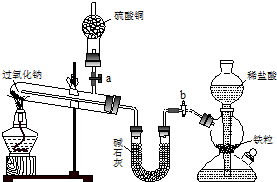
 Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.40 | 0.80 | 0 |
| n(O2)/mol | 0.24 | 0.48 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0 | 0 | 0.40 | |
| 含硫反应物的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A、丁中SO3的平衡转化率为α3=80% |
| B、该温度下,平衡常数的值为400 |
| C、平衡时,丙中c(SO3)是甲中的2倍 |
| D、平衡时,甲中O2的转化率小于乙中O2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应是非氧化还原反应 |
| B、在理论上可以利用该反应的原理做成燃料电池 |
| C、该反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=2 165 kJ?mol-1 |
| D、每生成18 g水,该反应转移2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
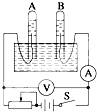 如图所示为电解水的装置,闭合开关S后,观察到电压表示数为6.0V,电流表示数为100mA.
如图所示为电解水的装置,闭合开关S后,观察到电压表示数为6.0V,电流表示数为100mA.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com