
| 1 |
| 2 |
| 2.8×10 -9 |
| 1×10 -4 |


科目:高中化学 来源: 题型:
| A、一定条件下,1.5 mol H2和0.5 mol N2充分反应后可得到NH3分子数为NA |
| B、足量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.3NA |
| C、常温常压下,18g H2O含有的电子总数为8NA |
| D、标准状况下,22.4L的己烯中含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油是纯净物,乙醇汽油是混合物 |
| B、煤干馏可以得到甲烷、苯和氨等重要化工原料 |
| C、乙烯、乙醇、和乙酸均能发生加成反应 |
| D、变质的油脂有难闻的特殊气味,是因为油脂发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别可以是( )
在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别可以是( )| 干燥气体a | 液体b | |
| A | NO2 | 水 |
| B | C12 | 饱和食盐水 |
| C | NH3 | 水 |
| D | CO2 | 4mol?L-1 NaOH溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
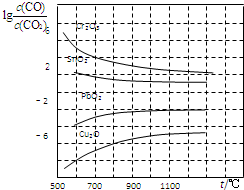 一氧化碳是一种用途相当广泛的化工基础原料.
一氧化碳是一种用途相当广泛的化工基础原料.| 50-80℃ |
| 180-200℃ |
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.1 | 0.4 |
| c(CO) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1s22s22p63s23p63d74s2 |
| B、1s22s22p63s23p63d54s1 |
| C、1s22s22p63s23p63d104s24p1 |
| D、1s22s22p63s23p64s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
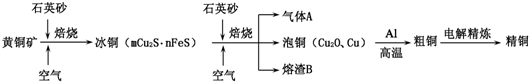
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com