
| A. | C2H5OH(1)+3O2(g)═2CO2(g)+3H2O(1);△H=-Q kJ/mol | |
| B. | C2H5OH(1)+3O2(g)═2CO2(g)+3H2O(1);△H=-$\frac{Q}{2}$ kJ/mol | |
| C. | $\frac{1}{2}$ C2H5OH(1)+$\frac{3}{2}$O2(g)═CO2(g)+$\frac{3}{2}$H2O(1);△H=-Q kJ/mol | |
| D. | C2H5OH(1)+3O2(g)═2CO2(g)+3H2O(1);△H=-2Q kJ/mol |
分析 燃烧a g乙醇(液态),生成二氧化碳气体和27g液态水,放出的热量为Q kJ,根据热化学方程式的意义,即产生1.5mol液态水,放热是QkJ,燃烧热是完全燃烧1mol物质所放出的热,据此回答.
解答 解:A、燃烧a g乙醇(液态),生成二氧化碳气体和27g液态水,放出的热量为Q kJ,根据热化学方程式的意义,即产生1.5mol液态水,放热是QkJ,如果产生3mol液态水,放热是2QkJ,故A错误;
B、燃烧a g乙醇(液态),生成二氧化碳气体和27g液态水,放出的热量为Q kJ,根据热化学方程式的意义,即产生1.5mol液态水,放热是QkJ,如果产生3mol液态水,放热是2QkJ,故B错误;
C、燃烧a g乙醇(液态),生成二氧化碳气体和27g液态水,放出的热量为Q kJ,根据热化学方程式的意义,即产生1.5mol液态水,放热是QkJ,但是燃烧热是完全燃烧1mol物质所放出的热,给定的反应是燃烧0.5mol乙醇的反应,故C错误;
D、燃烧a g乙醇(液态),生成二氧化碳气体和27g液态水,放出的热量为Q kJ,根据热化学方程式的意义,即产生1.5mol液态水,放热是QkJ,如果产生3mol液态水,放热是2QkJ,燃烧热是完全燃烧1mol物质所放出的热,该式子符合燃烧热的含义,故D正确.
故选D.
点评 本题考查了燃烧热的概念和热化学方程式的书写和计算,题目较简单,注意热化学方程式的意义是关键.


科目:高中化学 来源: 题型:解答题
 从“南澳一号”沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明.青花瓷胎体的原料--高岭土[Al2Si2O5(OH)x]可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石(KAlSi3O8),在1 300℃左右一次烧成的釉可形成精美的青花瓷.
从“南澳一号”沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明.青花瓷胎体的原料--高岭土[Al2Si2O5(OH)x]可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石(KAlSi3O8),在1 300℃左右一次烧成的釉可形成精美的青花瓷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g);△H12C(s)+O2(g)=2CO(g);△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/ (mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
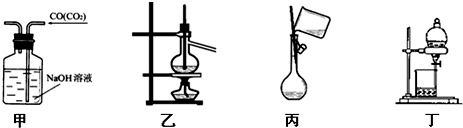
| A. | 用甲除去CO气体中的CO2气体 | |
| B. | 用乙分离沸点相差较大的互溶液体混合物 | |
| C. | 丙向容量瓶中转移液体 | |
| D. | 用丁分离互不相溶的两种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据酸分子中含有的氢原子个数、将酸分为一元酸、二元酸和多元酸 | |
| B. | 根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 | |
| C. | 混合物:铝热剂、福尔马林、水玻璃、漂白粉 | |
| D. | 明矾、水银、烧碱、硫酸均为强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g水在标准状况下的体积约为22.4L | |
| B. | 在标准状况下,22.4L氮气中含有NA个氮原子 | |
| C. | 17gNH3中含有的原子总数目为4NA | |
| D. | 80gNaOH溶解在1L水中,得到溶液的物质的量浓度为2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com