
| A. | 电离产生阳离子全部是H+化合物叫酸,根据其分子中氢原子的个数确定该酸的元数 | |
| B. | 依据组成元素的种类,将纯净物分为单质和化合物 | |
| C. | 根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物和酸性氧化物 | |
| D. | 根据分散质微粒直径大小,将分散系分为胶体、浊液和溶液 |
分析 A.酸:电离时生成的阳离子全部是H+的化合物;根据酸能电离出H+的个数分类为一元酸、二元酸等;
B.同种元素组成的纯净物为单质,不同种元素组成的纯净物为化合物;
C.根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物;
D.分散系分为溶液、胶体和浊液的本质区别是分散系分散质微粒大小.
解答 解:A.电离时生成的阳离子全部是H+的化合物是酸,根据酸能电离出H+的个数分类为一元酸、二元酸等,而不是关键分子中氢原子的个数,故A错误;
B.同种元素组成的纯净物为单质,不同种元素组成的纯净物为化合物,根据组成元素的种类将纯净物分为单质和化合物,故B错误;
C.根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物,含金属元素的氧化物可能为碱性氧化物如CaO、两性氧化物如Al2O3、酸性氧化物如Mn2O7,故C错误;
D.根据分散系分散质微粒大小将分散系分为溶液、胶体和浊液,故D正确;
故选D.
点评 本题考查物质的分类,题目难度不大,注意物质的分类的依据,不同的分类标准会得出不同的分类结果.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
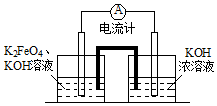 2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大.请完成下面问题:
2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大.请完成下面问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
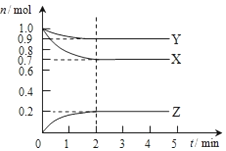 某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 目 的 | 试剂及方法 |
| 鉴别丝绸和棉布 | |
| 除去CO中混有少量CO2 | |
| 证明Na2CO3溶液呈碱性 | |
| 检验溶液中是否含Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
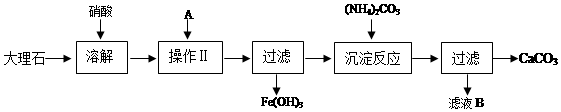
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量滤液,滴加过量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 |
| 若无白色沉淀 | 滤液中无Ca(OH)2 | |
| ②取少量滤液, 滴入过量盐酸 | 若出现 气泡 | 滤液中含Na2CO3 |
| 若无现象 | 滤液中无Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是呈电中性的,胶体是带电的 | |
| B. | 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 | |
| C. | 胶体的分散质可以通过过滤从分散剂中分离出来 | |
| D. | 胶体与其他分散系最本质的区别是:胶体粒子直径介于(1---100 )nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z2+2A2+=2A3++2Z-反应可以进行 | |
| B. | Z元素在②③反应中均被还原 | |
| C. | 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ | |
| D. | 还原性由强到弱顺序是A2+、B-、Z-、X2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com