
【题目】按要求填空:
(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______。
(2)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是________。
(二)、工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):
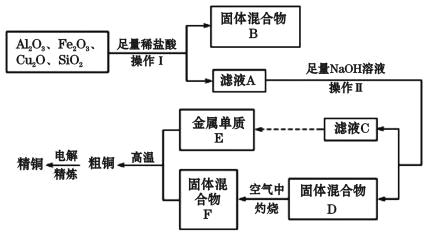
已知:Cu2O+2H+ =Cu+Cu2+ +H2O。
(3)固体混合物B的成分是____。
(4)滤液A中铁元素的存在形式为____(填离子符号),生成该离子与Fe元素的有关反应的离子方程式为_________、_____。
(5)向滤液C中通入足量CO2气体,除了CO2+OH-=HCO3-,主要的离子方程式有________。
【答案】Cl2+2Fe2+=2Fe3++2Cl- 隔离空气(或排除氧气对实验的影响) SiO2和Cu Fe2+ Fe2O3+6H+=2Fe3++3H2O 2Fe3++Cu=2Fe2++Cu2+ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
【解析】
(一)(1)氯气具有氧化性,能将氯化亚铁氧化,据此分析书写反应的离子方程式;
(2)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,结合空气中含有氧气分析解答;
(二)矿渣中含有Cu2O、Al2O3、Fe2O3、SiO2,Cu2O与盐酸反应生成Cu和Cu2+,SiO2与盐酸不反应,Fe2O3与盐酸反应生成Fe3+,与Cu反应生成Fe2+,固体混合物B为SiO2和Cu,滤液A中含有Cu2+、Fe2+、Al3+,加入足量的NaOH溶液,滤液C中含有AlO2-,金属E为Al,固体D为Cu(OH)2和Fe(OH)3的混合物,在空气中灼烧,F为CuO和Fe2O3的混合物,粗铜为Cu、Al和Fe的混合物,经过电解可得纯铜,据此分析解答(3)~(5)。
(一)(1)氯气具有氧化性,能氧化氯化亚铁为氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-,故答案为:Cl2+2Fe2+=2Fe3++2Cl-;
(2)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响,故答案为:隔离空气(或排除氧气对实验的影响);
(二)(3)根据上述分析,矿渣中含有Cu2O、Al2O3、Fe2O3、SiO2,只有SiO2与盐酸不反应,且Cu2O在酸性溶液中发生歧化反应生成铜,则固体B为SiO2和Cu,故答案为:SiO2和Cu;
(4)Cu2O与盐酸反应生成Cu和Cu2+,Fe2O3与盐酸反应生成Fe3+,Fe2O3+6H+=2Fe3++3H2O,反应生成的Fe3+能够与Cu反应生成Fe2+,2Fe3++Cu=2Fe2++Cu2+,有Cu剩余,则溶液中铁离子转化为亚铁离子,所以滤液A中铁元素的存在形式为Fe2+,故答案为:Fe2+;Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+;
(5)在滤液C中含氢氧化钠和偏铝酸钠溶液,通入足量CO2反应生成碳酸氢钠,氢氧化铝,反应的离子方程式为:OH-+CO2=HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。


科目:高中化学 来源: 题型:
【题目】中医典籍《肘后备急方》所载治疗疟疾的方法“青蒿一握,以水二升渍,绞取汁,尽服之”, 对屠呦呦团队研发治疗疟疾的特效药——青蒿素有巨大的启示作用。屠呦呦在对比实验中发现古法疗效低下,她设计的提取青蒿素的工艺可以简化成如下流程:
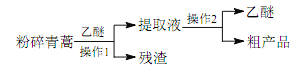
根据上述信息分析,下列判断或叙述中肯定错误的是
A. 从天然植物中提取有效成分治疗疾病是药物研发的重要途径
B. 将青蒿粉碎可以提高有效成分的提取率
C. 青蒿素易溶于水和乙醚
D. 操作 1 是过滤,操作 2 是蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是__________________________________。
(2)已知:20℃时溶解度/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________________。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有_______________________________________。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因________。
(4)步骤Ⅲ中,加入Na2SO3的目的是_______________________。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:______
![]()
②下面检测钝化效果的方法合理的是______。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)按下图所示装置进行实验,并回答下列问题:
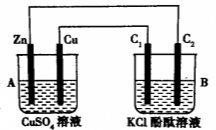
(1)判断装置的名称:A池为 ,B池为 ;
(2)锌极为 极,铜极上的电极反应式为 ,
石墨棒C1为 极,电极反应式为 ,
石墨棒C2附近产生的现象为 ;
(3)当C2极析出气体224mL(标准状况),锌的质量变化为 g(“增加”或“减少”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应: 2 A(g) + B(g) ![]() 3 C(g) + D(g)。试根据下图判断正确的是
3 C(g) + D(g)。试根据下图判断正确的是

A. 温度T1℃ 比 T2℃高
B. 正反应为放热反应
C. 甲图纵轴可以表示A的转化率
D. 甲图纵轴可以表示混合气体平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数与压强变化的关系如图所示,则下列叙述正确的是( )
pC(g) △H<0,在一定温度下,平衡时B的体积分数与压强变化的关系如图所示,则下列叙述正确的是( )

①m+n<p ②x点的状态是v正>v逆 ③n>p ④x点比y点的反应速度慢 ⑤若升高温度,该反应的平衡常数增大
A. ①②④ B. ②④
C. ③⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,
V(A) = V(B) = a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g) ΔH<0。达到平衡时,V(A) = 1.1a L。(连通管中气体体积不计)下列说法正确的是( )
2Z(g)+W(g) ΔH<0。达到平衡时,V(A) = 1.1a L。(连通管中气体体积不计)下列说法正确的是( )
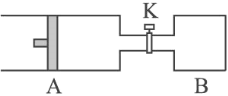
A. n(Z)B = 2n(Z)A
B. A容器中X的转化率为20%
C. 若向A和B中均再加入1molX和1molY,X的体积分数均增大
D. 打开K保持温度不变,又达到平衡时,A的体积为3.3a L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
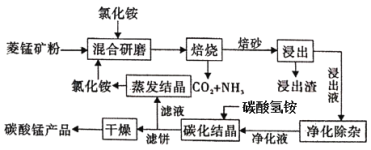
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
回答下列问题:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
(1)“焙烧”时发生的主要化学反应方程式为______________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:
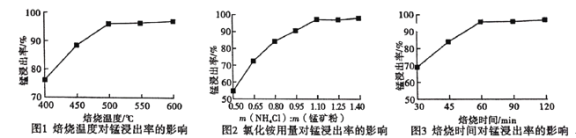
焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为___________.
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为____。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时, c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为_____________________________________________。
(5)流程中能循环利用的固态物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项的编号和曲线的编号一一对应,其中描述错误的是
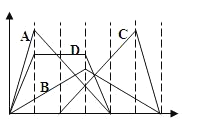
A. 向NaAlO2溶液中逐渐滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com