
分析 (1)根据物质的性质和质量守恒定律书写化学方程式;
(2)①测定醋酸钠溶液的pH,玻璃棒是用来蘸取用待测溶液;
②加热食盐溶液制备NaCl晶体,玻璃棒是搅拌避免局部受热液体飞溅;
③配制0.1mol/L的硫酸溶液,玻璃棒是加快溶解,引流作用;
④用淀粉-KI试纸检验溶液中氧化性离子,玻璃棒蘸取溶液滴在试纸上检验;
⑤配制10%的硫酸钠溶液,玻璃棒起到搅拌加速溶解的作用;
(3)检验沉淀是否洗净的方法是,取少量洗涤液,检验溶液中溶解的离子是否还存在;
(4)核磁共振谱用于测有机物中含有多少种氢原子;红外光谱分析有机物含有何种化学键和官能团;质谱法常用于测有机物相对分子质量;透射电子显微镜可以观察到微粒的大小,依此来进行判断;
(5)因为是用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3;
(6)根据n=cV计算n(Fe3+),根据电子转移守恒计算n(Ti3+),再根据Ti原子守恒计算n(TiO2),根据m=nM计算m(TiO2),进而计算TiO2的质量分数;
(7)NH4Fe(SO4)2溶液溅出,其物质的量浓度减小,消耗的体积增大,百分含量偏大;若终点俯视滴定管,读取的体积比实际消耗的体积偏小,质量分数偏小;仰视则相反,容量瓶是否干燥无影响.
解答 解:(1)设TiCl4的系数为1,根据元素守恒,TiO2•xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),
故答案为:TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl;
(2)①测定醋酸钠溶液的pH,玻璃棒是用来蘸取用待测溶液;
②加热食盐溶液制备NaCl晶体,玻璃棒是搅拌避免局部受热液体飞溅;
③配制0.1mol/L的硫酸溶液,玻璃棒是加快溶解,引流作用;
④用淀粉-KI试纸检验溶液中氧化性离子,玻璃棒蘸取溶液滴在试纸上检验;
⑤配制10%的硫酸钠溶液,玻璃棒起到搅拌加速溶解的作用,
实验操作中玻璃棒的作用完全相同的是②⑤,①④,
故答案为:BC;
(3)沉淀吸附溶液中的Cl-,根据F反应:Cl-+Ag+═AgCl↓,取少量洗涤液,检验溶液中溶解的离子是否还存在,
故答案为:取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净;
(4)核磁共振谱用于测有机物中含有多少种氢原子;红外光谱分析有机物含有何种化学键和官能团;质谱法常用于测有机物相对分子质量;透射电子显微镜可以观察到微粒的大小,故答案为:d;
(5)Fe3+与Ti3+反应,被还原为Fe2+,加入KSCN不显红色,当达到滴定终点时,再加入NH4Fe(SO4)2,溶液中Fe3+过量,会变成红色,
故答案为:溶液变成红色且半分钟内不褪色;
(6)n(Fe3+)=c mol/L×V×10-3L=cV×10-3mol,根据电子转移守恒可知n(Ti3+)=n(Fe3+)=cV×10-3mol,再根据Ti原子守恒n(TiO2)=cV×10-3mol,故m(TiO2)=cV×10-3mol×Mg/mol=cVM×10-3g,故TiO2的质量分数为$\frac{cVM×1{0}^{-3}g}{wg}$×100%=$\frac{cVM}{10w}$%;
故答案为:$\frac{cVM}{10w}$%;
(7)A、若终点俯视滴定管,读取的体积比实际消耗的体积偏小,质量分数偏小,故A不选;
B、NH4Fe(SO4)2溶液溅出,其物质的量浓度减小,消耗的体积增大,百分含量偏大,故B选;
C、容量瓶是否干燥无影响,故C不选;
d、配制标准溶液定容时,俯视刻度线,体积未到刻度线,标准溶液浓度增大,滴定消耗体积减小,测定结果偏低,故D不选;
故答案为:B.
点评 本题主要考查物质的制备、溶液的配制、含量测定等基本实验操作,题目难度中等,注意把握物质的性质为解题的关键,学习中注意积累,


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:选择题
| A. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| B. | 加碘盐是食盐中加入碘单质 | |
| C. | 石英可用于生产光导纤维 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
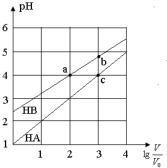 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| B. | 溶液中水的电离程度:a=c>b | |
| C. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c(B-)}{c(A-)}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学视角是现代人所必须具备的科学素养中的重要组成部分 | |
| B. | 元素周期律的发现过程体现了物质分类思想和方法的运用 | |
| C. | 能源是现代文明的原动力,能源的开发和利用离不开化学 | |
| D. | 自然界一切物质都是由离子构成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑧ | B. | ②③④ | C. | ①④⑥ | D. | ④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高燃料的燃烧效率的意义在于节约能源、节省资源、减少污染 | |
| B. | CO、NO、NO2、SO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | 按照绿色化学的原则,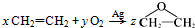 (式中的系数x,y,z均为整数),则(x+y+z)的最小数值为5 (式中的系数x,y,z均为整数),则(x+y+z)的最小数值为5 | |
| D. | 使用“无磷洗涤剂”,防止水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com