
【题目】FFC电解法可由金属氧化物直接电解制备金属单质,西北稀有金属材料研究院利用此法成功电解制备钽粉(Ta),其原理如图所示。下列说法正确的是
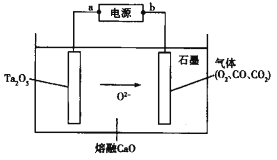
A. 该装置将化学能转化为电能
B. a极为电源的正极
C. Ta2O5极发生的电极反应为Ta2O5+10e—=2Ta+5O2—
D. 石墨电极上生成22.4 L O2,则电路中转移的电子数为4×6.02×1023
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组模拟工业上从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的工艺流程如下:(已知溶液D中通入过量的CO2得到白色沉淀)

请回答下列问题:
(1)操作Ⅰ的名称为________。
(2)不溶物A是_________________(填化学式),写出A与氢氧化钠溶液反应的离子方程式_________________________________。
(3)+3价的铝常或多或少地置换硅酸盐中+4价的硅而形成铝硅酸盐。已知某种铝硅酸盐主要成分的化学式为Al2Si2O5(OH)4,请将其改写成氧化物的组合形式________。
(4)溶液D中Al元素的主要存在形式为_____________(填离子符号)
(5)写出E→G的化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。下列说法不正确的是( )

A. 原料X与中间体Y互为同分异构体
B. 原料X可以使酸性KMnO4溶液褪色
C. 中间体Y能发生还原、加成、取代、氧化、水解反应
D. 1 mol依曲替酯只能与1 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
T(K) | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量______;充入氦气,混合气体的密度____(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①用等式表示Na2CO3溶液中含有H+ 、OH- 、HCO3-、H2CO3微粒间的关系_________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鹅去氧胆酸和胆烷酸都可以降低肝脏中的胆固醇,二者的转化关系如图,下列说法中正确的是
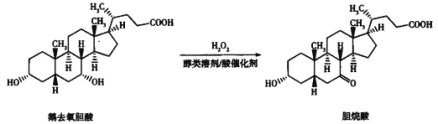
A. 二者互为同分异构体
B. 二者均能发生氧化反应和取代反应
C. 胆烷酸中所有碳原子可能处于同一平面内
D. 等物质的量的鹅去氧胆酸和胆烷酸与足量Na反应时,最多消耗Na的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体置于2L的密闭容器中,混合后发生如下反应:2A(g) + B(g) = 2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
A.用物质A表示的反应速率为0.3mol/(L·s)
B.用物质B表示的反应速率为0.3mol/(L·s)
C.2s时物质A的转化率为30%
D.2s时物质B的浓度为0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:

容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 原子半径:r(Y)>r(Z)>r(W)
B. 化合物N与乙烯均能使溴水褪色,且原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2019·福建省厦门市高中毕业班5月第二次质量检查]一种以磷酸工业副产物磷石膏(主要成分为CaSO4,杂质含H3PO4,SiO2,Al2O3等)制取高纯硫酸钙的流程如图所示。
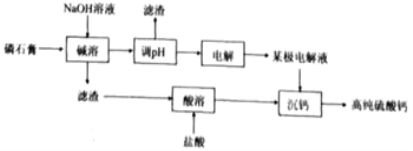
(1)磷石膏废弃会造成的环境问题为___________;
(2)“碱溶”中Al2O3发生反应的化学方程式为_________;
(3)含硅与含铝组分分布系数与pH关系如下图:
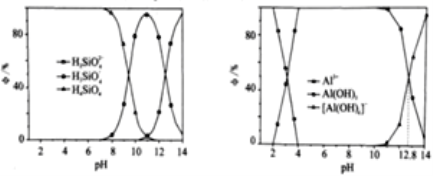
①“调pH”时,溶液的pH应调节为__________;
②Ksp[Al(OH)3]=__________;
③Al(OH)3(aq)+H2O![]() [Al(OH)4](aq)+H+(aq),则Ka[Al(OH)3]=__________;
[Al(OH)4](aq)+H+(aq),则Ka[Al(OH)3]=__________;
(4)“电解”采用双极膜电渗析法,装置如下图。
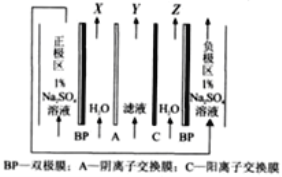
①“某极电解液”为________(填“X”、“Y”或“Z”)极。
②阴极电极反应式为____________。
(5)流程中可循环利用的物质有________________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com