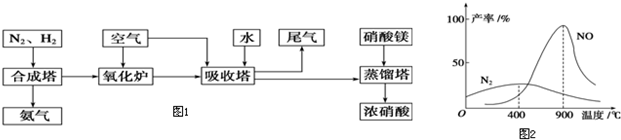
图1是煤化工产业链的一部分,试运用所学知识,解决下列问题:
I.已知该产业链中某反应的平衡表达式为:K=
,它所对应反应的化学方程式为
C(s)+H2O(g)?CO(g)+H2(g)
C(s)+H2O(g)?CO(g)+H2(g)
.
II.二甲醚(CH
3OCH
3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H
2为原料生产CH
3OCH
3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H
2(g)
CH
3OH(g)△H
1=-90.7kJ?mol
-1②2CH
3OH(g)
CH
3OCH
3(g)+H
2O(g)△H
2=-23.5kJ?mol
-1③CO(g)+H
2O(g)
CO
2(g)+H
2(g)△H
3=-41.2kJ?mol
-1(1)催化反应室中总反应的热化学方程式为
3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247KJ?mol-1
3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247KJ?mol-1
.830℃时反应③的K=1.0,则在催化反应室中反应③的K
>
>
1.0(填“>”、“<”或“=”).
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H
2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,则5min内CO的平均反应速率为
0.1mol/(L?min)
0.1mol/(L?min)
;若反应物的起始浓度分别为:c(CO)=4mol/L,c(H
2)=a mol/L;达到平衡后,c(CH
3OH)=2mol/L,a=
5.4
5.4
mol/L.
(3)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图2,CO转化率随温度变化的规律是
由图表可知,温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小
由图表可知,温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小
,其原因是
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小
.
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如图3所示.写出a电极上发生的电极反应式
CH3OCH3+3H2O-12e-=2CO2+12H+
CH3OCH3+3H2O-12e-=2CO2+12H+
.

![]() (
(![]() = v (
= v (![]() B.3
B.3![]() (
(![]() ) = 2 v
) = 2 v ![]()
![]() (
(![]() =
= ![]() v (
v (![]() )
D.
)
D.![]() (
(![]() = 3 v (
= 3 v (![]() )
) 智能训练练测考系列答案
智能训练练测考系列答案 (2013?无锡一模)天然气、煤炭气(CO、H2)的研究在世界上相当普遍.其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为:
(2013?无锡一模)天然气、煤炭气(CO、H2)的研究在世界上相当普遍.其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为: