
【题目】
有机物X、Y均为重要的工业原料,可由A和环己烯(![]() )为原料合成,路线如下(部分反应条件省略):
)为原料合成,路线如下(部分反应条件省略):

已知:ⅰ.X的结构简式是: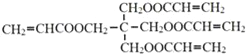
ⅱ.![]()
ⅲ.![]()
(1)X的化学式是____,A中含氧官能团的名称是_____;第①步反应的类型是___。
(2)下列有关说法正确的是_______。
a.H与苯酚可以用FeCl3溶液区分
b.G、H分别经一步反应都可得到环己烯
c.D的所有同分异构体在红外光谱仪中显示的信号(或数据)完全相同
d.试剂a是浓硫酸
e.反应②加高锰酸钾可以实现
(3)Y的结构简式是_____________________________________。
(4)已知1mo1W与1mol H2经加成反应生成1molE,写出W的同分异构体能同时满足下列条件的结构简式是_________________________________。
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生水解反应
③核磁共振氢谱显示为3组峰,且峰面积比为6:1:1
【答案】 C17H20O8 醛基 加成反应 ab ![]()

【解析】根据X的结构简式和D的分子式可知,D为CH2=CHCOOH,F为C(CH2OH)4,根据D的结构简式,逆推可知A与甲醛发生信息Ⅱ中的反应生成B,B发生消去反应生成C,C发生氧化反应得D,则A为CH3CHO,B为HOCH2CH2CHO,C为CH2=CHCHO.结合F的结构简式可知,A与3分子甲醛发生加成反应得到E,E再与氢气发生加成反应得到F,则E为(HOCH2)3CCHO.环已烯与溴化氢加成得G为![]() ,G在氢氧化钠水溶液、加热条件下发生水解得H为
,G在氢氧化钠水溶液、加热条件下发生水解得H为![]() ,环已醇发生氧化反应得环已酮,根据Y的分子式可知,环已酮与F发生信息Ⅲ中的反应得Y为
,环已醇发生氧化反应得环已酮,根据Y的分子式可知,环已酮与F发生信息Ⅲ中的反应得Y为![]() .
.
(1)由X的结构简式可知,X的化学式是C17H20O8,A为CH3CHO,A中含氧官能团是醛基,第①步反应的类型是加成反应;
(2)a.H为![]() ,不能与氢氧化钠溶液反应,溶液分层,苯酚能与氢氧化钠溶液反应,可以用氢氧化钠溶液可以区别,故a正确;b.G为
,不能与氢氧化钠溶液反应,溶液分层,苯酚能与氢氧化钠溶液反应,可以用氢氧化钠溶液可以区别,故a正确;b.G为![]() 、H为
、H为![]() ,均可以通过消去反应一步反应都可得到环己烯,故b正确;c.D为CH2=CHCOOH可以为CH2=CHOOCH、OHCCH2CHO等,含有的官能团或基团不同,故c错误;d.试剂a是氢氧化钠水溶液,故d错误;e.反应②发生醇的消去反应,需要浓硫酸,故e错误;故选ab;
,均可以通过消去反应一步反应都可得到环己烯,故b正确;c.D为CH2=CHCOOH可以为CH2=CHOOCH、OHCCH2CHO等,含有的官能团或基团不同,故c错误;d.试剂a是氢氧化钠水溶液,故d错误;e.反应②发生醇的消去反应,需要浓硫酸,故e错误;故选ab;
(3)Y的结构简式是:![]() ;
;
(4)1mo1W与1mol H2经加成反应生成1molE,W的同分异构体能同时满足下列条件:①能与饱和NaHCO3溶液反应产生气体,说明含有羧基,②既能发生银镜反应,又能发生水解反应,含有甲酸形成的酯基,③核磁共振氢谱显示为3组峰,且峰面积比为6︰1︰1,符合条件的W的同分异构体结构简式为: 。
。


科目:高中化学 来源: 题型:
【题目】已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1∶1。请回答:
(1)组成A分子的原子的核外电子排布式是________ ;
(2)B和C的分子式分别是________和________;C分子的立体结构呈________形,该分子属于________分子(填“极性”或“非极性”);
(3)向D的稀溶液中加入少量氯化铁溶液现象是________,该反应的化学方程式为 ________;
(4)若将1 moL E在氧气中完全燃烧,只生成1 mol CO2和2 mol H2O,则E分子的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为________,Y的轨道表示式为________;
(2)ZX2的分子式是________,YX2电子式是________ ;
(3)Y与Z形成的化合物的结构式是________,该化合物中化学键的种类是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将14.2g Na2SO4完全溶于水中,配成500 mL溶液,其物质的量浓度为__________;若从中取出50 mL,Na+物质的量浓度为___________;若将这50 mL溶液用水稀释至100 mL,所得溶液中SO42-的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示:
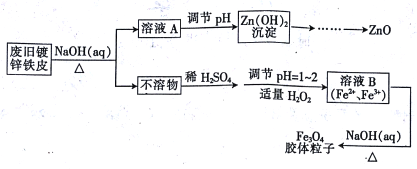
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为__mol/L
(7)稀硫酸也可以用浓硫酸和水配制。已知4mol/L的硫酸溶液密度为ρ1 g/cm3,2mol/L的硫酸溶液密度为ρ2 g/cm3。100g物质的量浓度为4mol/L 的硫酸溶液与___mL水混合,使硫酸的物质的量浓度减小到2mol/L。(用含ρ1、ρ2的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 惰性电极电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
C. 向NaClO和NaCl混合溶液中滴少量FeSO4溶液:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O
D. 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至沉淀物质的量最大:Al3++2SO42-+2Ba2++4OH-=[Al(OH)4]-+2BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X (g) +Y (g)![]() 2Z (g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
2Z (g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
下列说法正确的是
![]()
A. 反应前2 min的平均速率v(Z) =2.0×l0—3mol.L—l·min—l
B. 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C. 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 moI气体Y,到达平衡时,C (Z) =0.24 mol·L—l
D. 该温度下此反应的平衡常数:K=l. 44
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com