
如图是实验室中制备气体或者验证气体性质的装置图

(1)写出用A制取氯气的化学方程式
(2)利用图中装置制备纯净、干燥的氯气,并证明氧化性:Cl2>Fe3+装置B中的溶液的作用为 ;
装置D中加的最佳试剂为(填序号) .
供选试剂:a、浓硫酸 b、FeCl2溶液 c、KSCN与FeCl2的混合溶液 d、无水氯化钙
(3)在如图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具有氧化性和漂白性:B中为少量Na2S溶液、C中为品红溶液,D中应加入足量的(填溶液名称),E中加入 溶液(填化学式)
(4)证明碳元素的非金属性比硅 元素的强的现象为 ,实验2不严谨之处应如何改进 .
元素的强的现象为 ,实验2不严谨之处应如何改进 .
考点: 常见气体制备原理及装置选择.
专题: 实验设计题.
分析: (1)依据实验室制备氯气的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(2)依据氯气含有氯化氢分析装置B的作用,铁离子使硫氰化钾溶液变红色分析;
(3)根据元素的非金属性越强,最高价氧化物对应的水化物酸性越强,利 用强酸制弱酸来比较酸性强弱,根据CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,需要酸性高锰酸钾溶液除去;
用强酸制弱酸来比较酸性强弱,根据CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,需要酸性高锰酸钾溶液除去;
(4)根据CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,需要酸性高锰酸钾溶液除去并再次通过酸性高锰酸钾溶液是否除尽;空气中含有二氧化碳,可能干扰实验,故应排除空气中二氧化碳的干扰.
解答: 解:(1)制备氯气是利用装置加热生成,试剂是二氧化锰和浓盐酸加热反应生成,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)氯气中含有氯化氢气体,通过装置B饱和食盐水可以吸收氯化氢,含亚铁离子的物质被氯气氧化成铁离子使硫氰化钾变红色来来证明Cl2>Fe3+,因此选KSCN与FeCl2的混合溶液,
故答案为:除去氯气中的氯化氢;c;
(3)元素的非金属性越强,最高价氧化物对应的水化物酸性越强,利用碳酸的酸性强于硅酸,
二氧化碳能与硅酸钠反应制得硅酸沉淀,由于CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,
需要酸性高锰酸钾溶液除去,防止干扰检验二氧化碳;
故答案为:酸性高锰酸钾溶液,Na2SiO3;
(4)若D中高锰酸钾溶液不褪色,说明二氧化硫除尽,E中溶液变浑浊,说明含有二氧化碳气体;空气中含有二氧化碳,可能干扰实验,故应排除空气中二氧化碳的干扰,将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管可排除空气中二氧化碳的干扰,
故答案为:D中高锰酸钾溶液不褪色,E中溶液变浑浊;将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥.
点评: 本题考查实验室制备氯气的反应原理和装置分析,物质性质的比较,掌握基本操作和物质性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:
对可逆反应2A(s)+3B(g)⇌C(g)+2D(g)△H<0,在一定条件下达到平衡,下列有关叙述正确的是()
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高.
A. ①② B. ④ C. ③ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Q与R的摩尔质量之比为9:22,在反应X+2Y═2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量 之比为()
之比为()
A. 46:9 B. 32:9 C. 23:9 D. 16:9
查看答案和解析>>
科目:高中化学 来源: 题型:
分类法在化学学科发展中起到了非常重要的作用,下列分类依据合理的是()
①根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔现象分为溶液、胶体和浊液
④根据组成元素的种类将纯净物分为单质和化合物
⑤根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质.
A. ②④ B. ②③④ C. ①③⑤ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.对下列实验事实的解释错误的是()
现象 解释或结论
A SO2使酸性高锰酸钾溶液褪色 SO2表现还原性
B 浓硝酸在光照条件下变黄 浓硝酸不稳定,生成有色物质生成且能溶于浓硝酸
C 某溶液中加入浓NaOH溶液加热,放出气体能使湿润的红色石蕊试纸变蓝 该溶液中一定含有NH4+
D 将铜片放入浓硫酸中,无明显实验现象 铜在冷的浓硫酸中发 生钝化
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
对溶液中的离子反应存在下列几种说法,其中正确的是()
A. 不可能是氧化还原反应 B. 只能是复分解反应
C. 可能是化合反应 D. 不可能是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式表示正确的是()
A. 澄清石灰水中通入过量二氧化碳:OH﹣+CO2═HCO3﹣
B. 铜片跟三氯化铁溶液反应:Fe3++Cu═Cu2++Fe2+
C. 漂白粉溶液中通入少量SO2:Ca2++2ClO﹣+SO2+H2O═CaSO3↓+2HClO
D. Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Cl﹣、Fe2+、H2O2、I﹣、SO2均具有还原性,且在酸性溶液中的还原性依次增强.下列各反应不可能发生的是()
A. 2Fe2++Cl2═2Fe3++2Cl﹣
B. 2Fe3+十SO2十2H2O=2Fe2+十SO42﹣十4H+
C. H2O2十H2SO4=SO2↑十O2↑十2H2O
D. SO2十I2十2H2O=H2SO4十2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的化学物质,在生产生活中有重要的应用.试回答下列问题:
实验室制备氯气的化学方程式为MnO2+4HCl(浓)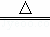 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)将氯气通入紫色石蕊试液中可观察到的现象是 请结合化学方程式和必要的文字描述解释其中的原因 ,;
(2)若该实验中有87g MnO2完全反应,产生的Cl2在标准状况下的体积为多少升?(写出计算步骤)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com