
| A. | 将NaH溶于水,得到的水溶液能导电说明NaH是离子化合物 | |
| B. | Fe(OH)3胶体和Fe(OH)3沉淀的化学性质不相同 | |
| C. | 乙醇分子中含羟基,可与金属钠反应生成氢气 | |
| D. | MnO2具有较强氧化性,可作为H2 O2分解反应的氧化剂 |
分析 A.NaH与水反应生成氢氧化钠和氢气;
B.Fe(OH)3胶体和Fe(OH)3沉淀的成分都是氢氧化铁;
C.乙醇分子中的羟基能与Na反应;
D.二氧化锰作催化剂.
解答 解:A.NaH与水反应生成氢氧化钠和氢气,不是NaH本身发生电离,不能说明NaH是离子化合物,故A错误;
B.Fe(OH)3胶体和Fe(OH)3沉淀的成分都是氢氧化铁,化学性质相同,故B错误;
C.乙醇分子中的羟基能与Na反应生成氢气,故C正确;
D.二氧化锰作为H2O2分解反应的催化剂,MnO2不是氧化剂,故D错误.
故选C.
点评 本题考查胶体、乙醇的性质以及催化剂等,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO3-、Fe2+ | B. | K+、Mg2+、I-、SO42- | ||
| C. | K+、Ca2+、Cl-、HCO3- | D. | Na+、Cl-、NO3-、S042- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2gH2中的原子数目为NA | |
| B. | 64gSO2中的原子数目为3NA | |
| C. | 1mol/LNaOH溶液中的Na+的数目为NA | |
| D. | 常温常下,11.2LCl2中的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
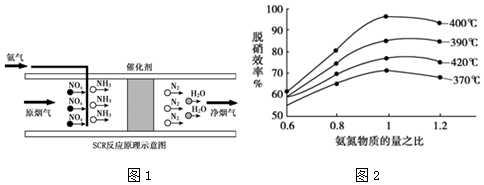
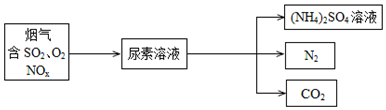
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 废FeCl3蚀刻液中加入少量铁粉,振荡 | 得到澄清溶液 | 蚀刻液中一定不含Cu2+ |
| B | 将Fe(NO3)2样品溶于H2SO4,滴加KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| C | 向两份蛋白质溶液中分别滴加饱和硫酸钠溶液和硫酸铜溶液 | 均有固体析出 | 蛋白质均发生变性 |
| D | 葡萄糖溶液与新制Cu(OH)2混合加热 | 生成砖红色沉淀 | 葡萄糖分子中含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
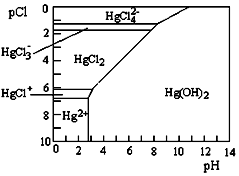 Hg是水体污染的重金属元素之一.水溶液中 二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]下列说法中不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中 二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]下列说法中不正确的是( )| A. | 配制Hg(NO3)2溶液时,为了防止Hg2+水解,应将Hg(NO3)2固体溶于浓硝酸后再稀释 | |
| B. | 当c(Cl-)=0.1 mol•L-1,pH<8时,汞元素主要以HgCl3-形式存在 | |
| C. | HgCl2是一种弱电解质,其电离方程式是:2HgCl2?HgCl++HgCl3- | |
| D. | 当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
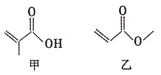
| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能发生取代、加成和水解反应 | |
| C. | 甲的一种同分异构体能发生银镜反应 | |
| D. | 等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(H2CO3)和c(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA | |
| B. | 5g 21H和31H的混合物发生热核聚变反应:21H+31H→42He+10n,净产生的中子(10n)数为NA | |
| C. | 1L 0.1mol/L乙醇溶液中存在的共价键总数为0.8NA | |
| D. | 56g 铁与足量氯气反应,氯气共得到3NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com