
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.89 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +2 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).分析 由元素的性质可知,①只有-2价,则①为O;④、⑦中化合价相同,半径不同,则④为P,⑦为N;⑤为Cl,结合原子半径可知,②为Mg,③为Be,⑥为Na,⑧为Al,以此来解答.
解答 解:由元素的性质可知,①只有-2价,则①为O;④、⑦中化合价相同,半径不同,则④为P,⑦为N;⑤为Cl,结合原子半径可知,②为Mg,③为Be,⑥为Na,⑧为Al,
(1)③的元素符号是Be;①的元素名称是氧,故答案为:Be;氧;
(2)这8种元素的最高价氧化物的水化物中,酸性最强的化合物的名称是高氯酸.②与⑤形成的化合物为MgCl2,其电子式是 ,含离子键,为离子化合物,故答案为:高氯酸;
,含离子键,为离子化合物,故答案为:高氯酸; ;离子;
;离子;
(3)非金属性N>P,则④和⑦的氢化物的稳定性为NH3>PH3,故答案为:NH3>PH3;
(4)⑥最高价氧化物对应水化物跟⑧的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(5)金属性Mg>Al,设计的简单的实验步骤和现象为取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,镁与盐酸反应比铝剧烈( 或与热水、原电池、最高价氧化物的水化物的碱性比较等),
故答案为:取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,镁与盐酸反应比铝剧烈.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质推断元素、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
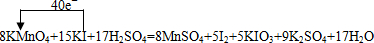
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、Cl-、NO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、HCO3- | D. | Al3+、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(C)=0.5mol/(L•min) | D. | v (D)=0.45mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3gNa在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6 L NH3中含有的氢原子数目为0.75NA | |
| C. | 1L0.1mol/LH3PO4溶液中含有的离子数目为0.4NA | |
| D. | 1个C02分子的质量为$\frac{44}{N_A}g$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
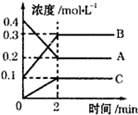 如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图象,回答问题:
如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图象,回答问题: 2B+C.
2B+C.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com