
一种检测驾驶员是否酒后驾车的仪器工作原理是:橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇具有还原性 ④乙醇是烃的含氧衍生物 ⑤乙醇可与羧酸在浓硫酸的作用下发生取代反应
A. ①③ B.②③
C. ②⑤ D.①④
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:

 有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以
验证反应实质。实验时,往100 mL大试管中先加40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图)。仔细观察,回答下列问题:
(1)如何从试剂瓶中取用金属钠?剩余的Na能否放回原试剂瓶?
(2)有关钠反应的现象是_________________________________________________。
(3)大试管的溶液中出现的现象:_________________________________________。
(4)装置中液面的变化:大试管内______;长颈漏斗内________。
(5)写出钠与硫酸亚铁溶液反应的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如图所示。
|
材料二:Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu,Cu2O+2H+=Cu2++Cu+H2O。
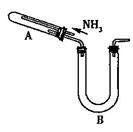 请回答下列问题:
请回答下列问题:
(1)在实验室里,该学习小组设计下列制取纯净干燥氨气的方案,简易、可行的最佳方案是 。
A、加热氯化铵固体,再通过碱石灰。
B、在N2和H2的混合气体中加入铁触媒,并加热至500℃,再通过碱石灰。
C、加热浓氨水,再通过碱石灰。
D、在生石灰中加入浓氨水,再通过碱石灰。
(2)为证明NH3还原CuO的反应中有水生成,B中应放入的试剂是 。
(3)当观察到 (填现象),即表明A中的反应已经完成。
(4)该小组欲用体积比为1:4的稀硫酸作试剂,检验反应是否有Cu2O固体生成。现用98%的浓硫酸配制1:4的稀硫酸,所需的玻璃仪器除了胶头滴管外还有 。可证明还原产物中含有Cu2O的操作及现象是 。
(5)请写出A中生成Cu2O的化学方程式 。
(6)若用定量的方法测定该反应是否生成Cu2O,最简便且准确的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在苯的同系物中,加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是( )
A.苯的同系物分子中,碳原子数比苯多
B.苯环受侧链影响,易被氧化
C.侧链受苯环影响,易被氧化
D.由于侧链与苯环的相互影响,使侧链和苯环均易被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
普伐他汀是一种调节血脂的药物,其结构如图。下列关系普伐他汀的性质描述不正确的是( )
A.能与FeCl3溶液发生显色反应
B.能使酸性KMnO4溶液褪色
C.能发生加成、取代、消去反应
D.1mol该物质在溶液中最多可与2molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学
B.蔗糖、淀粉、油脂及其水解产物均为非电解质
C.通过红外光谱分析可以区分乙醇和乙酸
D.石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求书写方程式:
(1)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
①写出一个包含上述七种物质的氧化还原反应方程式,并配平__________________。
②在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO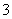 反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式_____________________________。
反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式_____________________________。
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O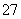 ,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式________________________________________________________________________
,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式________________________________________________________________________
________________________________________________________________________。
(3)KMnO4的氧化性随pH的减小而增大,在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2。三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式______________________________________________________
________________________________________________________________________。
(4)已知:①MnO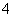 +e-―→MnO
+e-―→MnO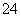 (绿色)(强碱性条件)
(绿色)(强碱性条件)
②MnO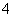 +8H++5e-―→Mn2+(无色)+4H2O(强酸性条件)
+8H++5e-―→Mn2+(无色)+4H2O(强酸性条件)
将KMnO4溶液滴入NaOH溶液中微热,得到透明的绿色溶液,写出反应的离子方程式________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是
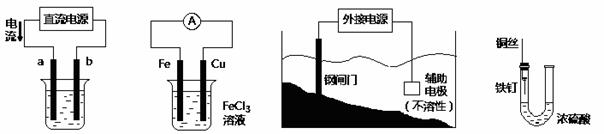
① ② ③ ④
 A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com