
| 0.224L |
| 22.4L/mol |
| 0.05mol |
| 0.1L |


科目:高中化学 来源: 题型:
| A、某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B、乙与氧气的摩尔质量相同,则乙属于分子晶体,其沸点一定和氧气相近 |
| C、丙中含有第二周期IVA族的元素,则丙一定是甲烷的同系物 |
| D、丁和甲中各元素质量比相同,则1mol 丁分子含有3NA个共用电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO3已部分氧化 |
| B、加入Ba(NO3)2溶液所生成的沉淀一定含有BaSO4 |
| C、加入HNO3后的沉淀一定是BaSO4 |
| D、此实验不能确定Na2SO3是否被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
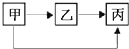
| 物质 选项 | 甲 | 乙 | 丙 |
| A | CuO | CO2 | H2O |
| B | C | CO | CO2 |
| C | CaCO3 | CaO | Ca(OH)2 |
| D | H2SO4 | H2O | H2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PH<7 |
| B、PH=7 |
| C、PH>7 |
| D、上述三种均有可能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com