
| A | B | C | D | |
| 物质 | CCl4 | H2SO4(浓) | KClO3 | P4 |
| 危险警告标签 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.四氯化碳不易燃烧,不能用易燃标志;
B.浓硫酸具有强腐蚀性,应贴腐蚀品的标志;
B.KClO3属于易爆物;
D.白磷为剧毒品,需要贴剧毒品标志.
解答 解:A.四氯化碳(CCl4)是一种高效灭火剂,不是易燃物品,所贴的标签不合理,故A选;
B.浓硫酸具有强烈的腐蚀性,应贴腐蚀品的标志,图为腐蚀品标志,所贴的标签合理,故B不选;
C.KClO3属于易爆物,故应贴爆炸品的标志,图为爆炸品标志,故C不选;
D.P4有剧毒,图为剧毒品标志,所贴的标签合理,故D不选;
故选A.
点评 本题考查危险品标志判断,题目难度不大,明确常见化学试剂的性质及标志为解答关键,解这类题时,首先要知道各种物质的性质,然后根据各个标签所代表的含义进行分析判断.


科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液有白色沉淀生成,证明原溶液中一定有Cl- | |
| B. | 加入稀HNO3酸化的BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO42- | |
| C. | 向某溶液中加入Ba(NO3)2溶液无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl- | |
| D. | 已知丙酮是无色液体,不溶于水,密度小于水,分离水和丙酮的最合理方法为蒸馏或蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器甲中分子总数多 | B. | 容器甲中C的浓度大 | ||
| C. | 容器甲中反应速率快 | D. | 容器甲中转化率大 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

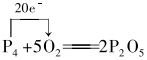 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  :2-甲基丙烯 :2-甲基丙烯 | B. | (CH3)2CHCH(CH3)2:1,4-而甲基丁烷 | ||
| C. | 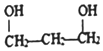 :1,3-二丙醇 :1,3-二丙醇 | D. | 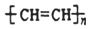 :聚乙烯 :聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
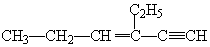 ,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 4、3、6 | B. | 4、3、8 | C. | 2、5、4 | D. | 4、4、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
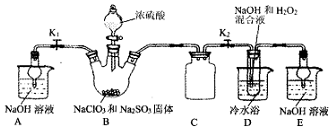
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com