
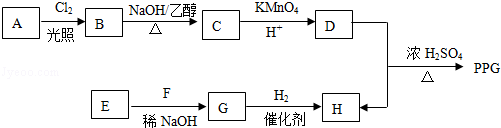
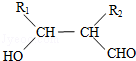
 .
. .
.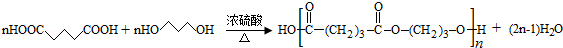 .
.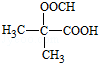 (写构简式)
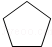
(写构简式) 分析 烃A的相对分子质量为70,由$\frac{70}{12}$=5…10,则A为C5H10,核磁共振氢谱显示只有一种化学环境的氢,故A的结构简式为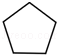 ;A与氯气在光照下发生取代反应生成单氯代烃B,则B为
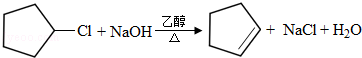
;A与氯气在光照下发生取代反应生成单氯代烃B,则B为 ,B发生消去反应生成C为
,B发生消去反应生成C为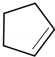 ,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(
,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(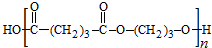 ),以此来解答.
),以此来解答.
解答 解:(1)由上述分析可知,A的结构简式为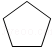 ,故答案为:
,故答案为: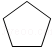 ;
;
(2)由B生成C的化学方程式为: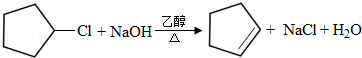 ,
,
故答案为: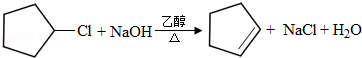 ;
;
(3)由E和F生成G的反应类型为加成反应,A的化学名称为环己烷,故答案为:加成反应;环己烷;
(4)①由D和H生成PPG的化学方程式为: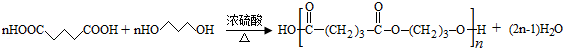 ,
,
故答案为: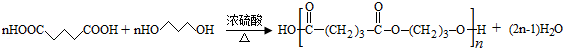 ;
;
②若PPG平均相对分子质量为10000,则其平均聚合度约为$\frac{10000}{12×8+16×4+1×12}$≈58,故答案为:b;
(5)D为HOOC(CH2)3COOH,它的同分异构体中能同时满足:①能与饱和NaHCO3溶液反应产生气体,说明含-COOH,②既能发生银镜反应,又能发生水解反应,含有醛基、羧基,D中共5个C,则C-C-C上的2个H被-COOH、-OOCH取代,共为3+2=5种,含其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是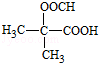 ,故答案为:5;
,故答案为:5;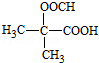 .
.
点评 本题考查有机物的合成,为高频考点,把握合成流程中官能团的变化、碳链骨架、有机反应为解答的关键,侧重分析与推断能力的考查,注意有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 6g 12C中约含有3.01×1023个碳原子 | |
| B. | 1 mol任何物质都含有6.02×1023个分子 | |
| C. | 1 mol O2的质量是32 g•mol-1 | |
| D. | 64 g氧相当于2 mol氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A | B | C | D |
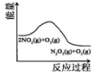 | 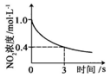 |  | 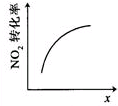 |
| 升高温度,平衡常数 减小 | 0~3s内,反应速率为v(NO2)=0.2mol•L-1•s-1 | t1时仅加入催化剂,平 衡向正方向移动 | 达平衡时,仅改变x, 则x为c(O2) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氯乙烷与四氯乙烷的同分异构体数相同 | |
| B. | 在光照条件下,乙烷与氯气反应不能制备纯净的二氯乙烷 | |
| C. | 二氯乙烷和硝酸银溶液反应产生白色沉淀 | |
| D. | 二氯乙烷发生消去反应可以得到乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
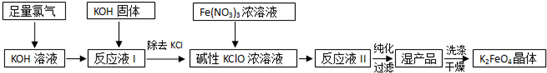
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
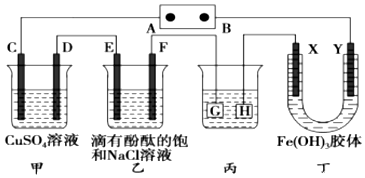
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 配制MgCl2、AlCl3溶液中分别通入氨气 | 比较镁、铝的金属性强强弱 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
| D | 向NaBr溶液中滴入少量的氯水和CCl2,振荡、静置,溶液下层呈橙红色 | Cl-的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com