
【题目】如图为相互串联的甲乙两个电解池,请回答:
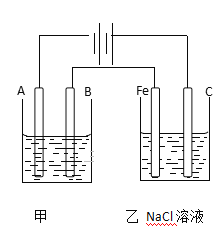
(1)甲池若为用电解精炼铜的装置,A是_________极,材料是__________,电极反应为_____________,B是___________极,材料是_______________,电极反应为_________,电解质溶液为________。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为_________。
【答案】 阴极 纯铜 Cu2+ +2e– == Cu 阳极 粗铜 Cu–2e– == Cu2+ CuSO4溶液 4.48L
【解析】试题分析:(1)电解法精炼铜,粗铜作阳极、精铜作阴极,硫酸铜作电解质溶液;(2)乙槽阴极是铁,阴极生成氢气,根据电子守恒计算乙槽阴极放出氢气在标准状况下的体积。
解析:(1)电解法精炼铜,粗铜作阳极、精铜作阴极,硫酸铜作电解质溶液,根据装置图,A与电源负极相连,A是阴极,材料是纯铜,阴极发生还原反应,电极反应为Cu2+ +2e– == Cu;B与电源正极相连,B是阳极,材料是粗铜,阳极发生氧化反应,电极反应为Cu–2e– == Cu2+;电解质溶液为CuSO4溶液;(2)甲槽阴极生成12.8gCu,转移电子![]() ,乙槽阴极反应为
,乙槽阴极反应为![]() ,根据电子守恒 ,转移0.4mol电子生成0.2mol氢气,在标准状况下的体积为
,根据电子守恒 ,转移0.4mol电子生成0.2mol氢气,在标准状况下的体积为![]() 。
。


科目:高中化学 来源: 题型:
【题目】一定温度下某容积不变的密闭容器中,可逆反应C(s)+H2O(g)![]() CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
A. 体系的压强不再发生变化 B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2 D. 1 mol H—H键断裂的同时断裂2 mol H-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示原电池的总反应为Cu(s)+2Ag+(aq)![]() Cu2+(aq)+2Ag(s),下列叙述正确的是
Cu2+(aq)+2Ag(s),下列叙述正确的是
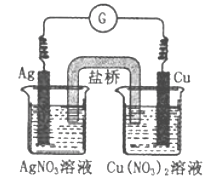
A. 电子从银电极经导线流向铜电极
B. 工作一段时间后,右烧杯中溶液的pH变小
C. 电池工作时,Cu2+向铜电极移动
D. 将AgNO3溶液更换为Fe(NO3)3溶液,电流计指针反向偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为________________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有________。
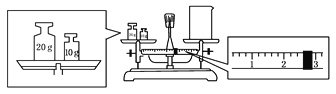
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为____________ g,要完成本实验该同学应称出____________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利的一位科学家合成了一种新型的氧分子(其分子式为O4),在相同条件下,等质量的O4和O2具有相同的
A.分子数B.原子数C.体积D.物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O=Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。

A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是工业上是合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯:![]() (g)
(g)![]()
![]() (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1
请回答下列问题:
(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则氢气的燃烧热为________kJ·mol-1(用含有Q、b、c的表达式表示,其中Q、b、c均大于0)。
(2)673 K时,在一恒容密闭容器中充入5 mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,则a________5。
(3)在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如图所示。
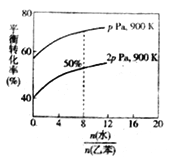
①加入水蒸气稀释剂能提高乙苯转化率的原因是___________________________。
②用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=________。
③改变下列条件,能使乙苯的反应速率和转化率一定增大的是________(填标号)。
A.恒容时加入稀释剂水蒸气 B.压强不变下,温度升至1500 K
C.在容积和温度不变下充入Ar D.选用催化效果更好的催化剂
(4)已知苯乙烯可催化氧化生成苯乙醛:![]() (g)+2O2→
(g)+2O2→![]() + CO2+H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为_________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________mol。
+ CO2+H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为_________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知弱酸乙(HA)的酸性比甲酸(HB)强,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是 ( )
A. c(OH)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢溶液可作为采矿业废液消毒剂,如消除采矿废液中剧毒的氰化钾,反应方程式为KCN+H2O2+H2O=A+NH3↑(已配平),请回答:(提示:![]() 、
、![]() )
)
(1)生成物A的化学式是__________________________________________。
(2)该反应是否是氧化还原反应?________(填写“是”或“否”),其理由是_____________________。若是,则被还原的元素是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com