
| A. | 该物质中不一定含有氧元素 | |
| B. | 该物质的分子组成必须满足n(C)=n(H) | |
| C. | 该物质中一定含有氧元素,且必须满足n(C)=n(O) | |
| D. | 该物质一定不溶于水 |
分析 有机物充分燃烧后生成CO2、H2O,再通过足量的Na2O2,发生反应2CO2+2Na2O2=2Na2CO3+O2中过氧化钠增重等于与CO2等物质的量的CO质量;发生反应2H2O+2Na2O2=4NaOH+O2中,过氧化钠增重等于与H2O同物质的量的H2质量,即该有机物的化学式一定满足nCO•mH2,完全燃烧后过氧化钠增重等于该物质的质量,据此结合选项解答.
解答 解:有机物充分燃烧后生成的CO2、H2O与Na2O2发生反应有:2CO2+2Na2O2=2Na2CO3+O2、2H2O+2Na2O2=4NaOH+O2,反应2CO2+2Na2O2=2Na2CO3+O2中过氧化钠增重等于与CO2等物质的量的CO质量;发生反应2H2O+2Na2O2=4NaOH+O2中,过氧化钠增重等于与H2O同物质的量的H2质量,即该有机物的化学式一定满足nCO•mH2,完全燃烧后过氧化钠增重等于该物质的质量,
A.根据分析可知,该有机物分子中一定含有氧元素,故A错误;
B.该有机物分子组成满足nCO•mH2形式即可,无法判断C、H的量,故B错误;
C.结合分析可知,该有机物分子组成满足nCO•mH2形式,则必须满足n(C)=n(O),故C正确;
D.题中信息无法判断该物质的水溶性,故D错误;
故选C.
点评 本题考查化学方程式的计算、钠的重要化合物性质等知识,题目难度中等,根据方程式得出固体增加的质量相当于CO和H2的质量为解答该题的关键,试题侧重考查学生的分析、理解能力.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | NH3 | Ca(Cl)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | SO2 | Ba(NO3)2 |
| A. | ②④ | B. | ①②④⑤ | C. | ①③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
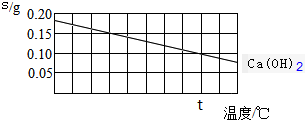
| A. | 氢氧化钙的溶解是吸热过程 | |
| B. | 温度升高时氢氧化钙溶解的速度减慢 | |
| C. | t℃时氢氧化钙的Ksp约等于2.46×10-4 | |
| D. | 向含有Ca(OH)2和Mg(OH)2两种沉淀的悬浊液中滴加NaOH浓溶液,分散系中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$的比值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 例如:
例如:
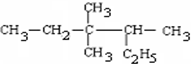 的名称3,3,4-三甲基己烷
的名称3,3,4-三甲基己烷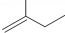 的名称2-甲基-1-丁烯.
的名称2-甲基-1-丁烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
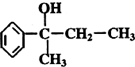 在工业上用基础的石油产品(乙烯、丙烯等)进行合成.合成A的过程可表示为:
在工业上用基础的石油产品(乙烯、丙烯等)进行合成.合成A的过程可表示为: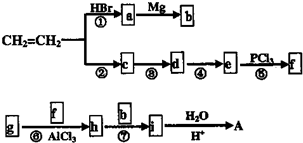
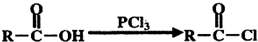
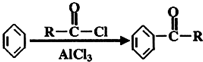
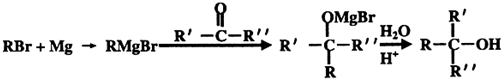
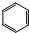 ;
;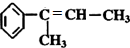 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2是电池的负极 | |
| B. | 负极的电极反应式为:Pb(s)+SO42-(aq)-2e -=PbSO4(s) | |
| C. | 铅蓄电池属于一次电池 | |
| D. | 电池放电时,溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
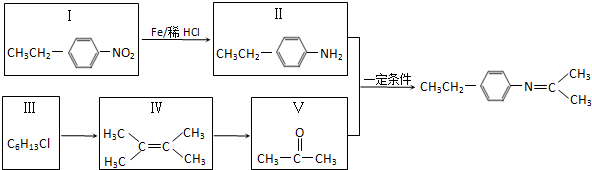
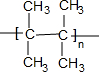 .
.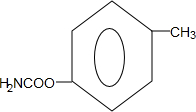 (写出一种).
(写出一种).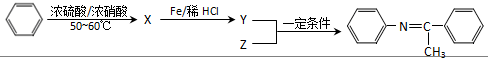
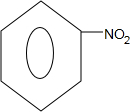 ,Z的结构简式为
,Z的结构简式为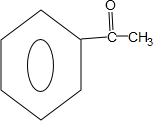 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com