
����Ŀ��ʵ��������NaOH��������0.1molL��1��NaOH��Һ500mL��
��1����ʵ������õ�����������ƽ��ҩ�ס����������ձ�����ͷ�ιܡ�����____��
��2��Ҫ��ɱ�ʵ���ͬѧӦ�Ƴ�______g NaOH��
��3�������ƹ����У���������������ȷ�ģ����в�����Ũ����Ӱ�����__������ţ���
��û��ϴ���ձ��Ͳ����� ��ת����Һʱ������������������ƿ���� ������ƿ�����������������ˮ �� ���ݺ�����ƿ������ҡ�ȣ����ú�Һ����ڿ̶��ߣ��ټ�ˮ���̶��ߣ�
���𰸡�500mL����ƿ 2.0 ��
��������
��1������ʵ������IJ����Լ�ÿ��������Ҫ����ȷ����Ӧ����������
��2������m=cvM��������NaOH��������
��3���������������ʵ����ʵ��������Һ�������Ӱ�죬����c=![]() �����жϡ�
�����жϡ�
��1����NaOH��������0.1 molL��1��NaOH��Һ500mL�����õ�����������ƽ��ҩ�ס����������ձ�����ͷ�ιܡ�����500mL����ƿ��
�ʴ�Ϊ��500mL����ƿ��
��2��Ҫ��ɱ�ʵ���ͬѧӦ����NaOH���������Ϊ0.5L��0.1mol/L��40g/mol��2.0g��
�ʴ�Ϊ��2.0��
��3����û��ϴ���ձ��Ͳ����������ʼ��٣�Ũ��ƫ�ͣ�
��ת����Һʱ������������������ƿ���棬���ʼ��٣�Ũ��ƫ�ͣ�
������ƿ�����������������ˮ��Ӱ��������������
�ܶ��ݺ�����ƿ������ҡ�ȣ����ú�Һ����ڿ̶��ߣ��ټ�ˮ���̶��ߣ���Һ������ӣ�Ũ��ƫ�͡�
�ʴ�Ϊ������


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��G�������л��ϳɺ�ҩ�����죬һ�ֺϳ�G��·�����£���ش�������⡣
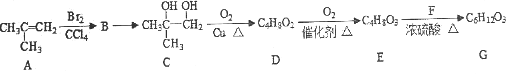
��֪����RCH2Br![]() RCH2OH;
RCH2OH;
��RCHO![]() RCOOH;
RCOOH;
��G�����к����ǻ���
��1������ϵͳ��������A����_________________��
��2��A��B��Ӧ����Ϊ__________��B��C��Ӧ�Լ��ͷ�Ӧ������_______________��
��3��D�����й���������Ϊ___________________��
��4��C��D��Ӧ�Ļ�ѧ��Ӧ����ʽΪ________________________________________��
��5��E��G��Ӧ�Ļ�ѧ��Ӧ����ʽΪ________________________________________��
��6����������������E��ͬ���칹�廹��______�֣�������E�������к˴Ź���������������壬�����Ϊ3��3��1��1��ͬ���칹��Ľṹ��ʽΪ_____________��
����̼������Һ��Ӧ������������ڷ�������![]() �ṹ��
�ṹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������̼���⡢������Ԫ����ɣ���������ͼ��C-H����O-H����C-O���������գ����л������Է���������60������л���Ľṹ��ʽ�ǣ� ��
A. CH3CH2OCH3 B. CH3CH��OH��CH3
C. CH3CH2CH2OH D. CH3CH2CHO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�����������ռ��������ǣ�NA��ʾ�����ӵ��������� ��
A.18gH2OB.NA����������C.44.8L HCLD.����5NA����ԭ�ӵ�H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ��ͬѹ�£����ڵ�������SO2��CO2�������壬�������и����ֵ��
(1)Ħ��������___________��
(2)�ܶȱ�___________��
(3)���ʵ�����___________��
(4)�����Ϊ___________��
(5)��������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ������ڹ���18�����У���������Ϊ18�У���������ǵ�1�У�ϡ�������ǵ�18�С������ֹ涨������˵����ȷ���ǣ� ��
A. ��9��Ԫ����û�зǽ���
B. ��15��Ԫ�ص�ԭ�������ĵ����Ų���ns2np5
C. ���������Ų�Ϊns2��Ԫ��һ���ڵ�2��
D. ��11��12��Ϊd����Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������34 g ij���壬����Ħ������Ϊ17g.mol-1����
(1)������Ϊ_____________mol
(2)����������������Ϊ_________ NA
(3)�������ڱ�״���µ����Ϊ_________ L
(4) ________g H2O�е���ԭ����Ŀ�뱣״��22.4LCO2�е���ԭ����Ŀ��ͬ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ԫ�أ��纬�������Ӱ�������֬��Ĵ�л����������������ж�����ҵ��������ȡ����ѭ�����շ�ֹ������Ⱦ��

���������գ�
��1����Cr2O72-���ӵķ�ˮ��������������Fe3O4��������Ӧ�����ӷ���ʽ��������ƽ�����ӷ�Ӧ����ʽ��
_____Cr2O72-+Fe3O4+H+��Cr3++Fe3++H2O
��2����ҵ�ϴ�����Cr2O72-�ķ�ˮʱ��һ�㽫�綾��Cr2O72-ת��ΪCr3+,��̼Ϊ����������������������NaCl��Cr2O72-�����Է�ˮ��д���缫��Ӧ������_____________________������_______________________��������������Ŀ���ǣ�_____________________
��3����Ӧ���ǿ��淴Ӧ����Na2CrO4��Һ�м���ϡ���ᣬ��Һ�ɻ�ɫ��ɳ�ɫ��д���÷�Ӧ�����ӷ���ʽ��______________________
��4����֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ9.0��10��12��1.56��10��10��������ͬŨ�ȵ�Na2CrO4��NaCl�Ļ����Һ����μ�����������Һ���������ɵij�����__________
��5����������Ӧ�����Һ�м������Һ���÷�ˮ��pH����8��10�������ʵ����¶ȣ�ʹ�����еĽ���������ȫ��ת��Ϊ�������������õ�Cr(OH)3�����������ֿ�ת���K2Cr2O7��������K2Cr2O7������ȷ�ⶨNa2S2O3��Һ�����ʵ���Ũ�ȣ��������£��� Cr2O72- +6I- + 14H+ ��3I2 + 2Cr3+ + 7H2O �� 2S2O32- + I2��S4O62- + 2I- ��ȷ��ȡ������K2Cr2O7 0.294g �������Һ����Na2S2O3��Һ�ζ�������Na2S2O3��Һ25.00mL����Na2S2O3��Һ�����ʵ���Ũ��Ϊ_____________________��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������XͶ�������Y�У������ɰ�ɫ�������ų�һ����ɫ���壬��������ȼ�գ���������ˮ����X��Y�ֱ������( )
A.�ƺ��Ȼ�����ҺB.�����ռ���ҺC.�������ƺ��Ȼ�����D.п��ϡ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com