
分析 (1)①已知:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.5kJ•mol-1①
N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1②,
根据盖斯定律①-②×2可得:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g),据此计算;
②尿素[CO(NH2)2]也可以将NOx反应生成N2和H2O,CO(NH2)2与NO2反应生成氮气、二氧化碳和水;
(2)①根据氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量计算;
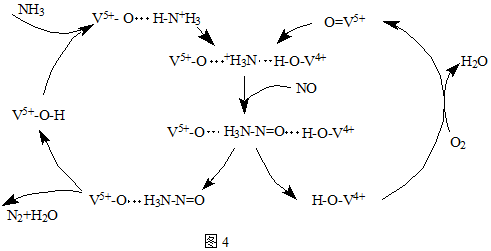
②V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成VOSO4,VOSO4 分解生成V2O5、SO2、SO3;
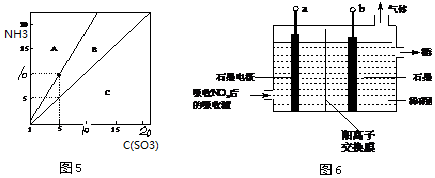
③SO3进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵,依据氨气和三氧化硫的物质的量之比判断生成产物;
(3)①电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOx生成亚硝酸[Ka(HNO2)=5.1×10-4],再将吸收液导入电解槽电解,使之转化为硝酸,阳极上亚硝酸失电子发生氧化反应;
②O3氧化NO2产生N2O5.
解答 解:(1)①已知:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.5kJ•mol-1①
N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1②,
根据盖斯定律①-②×2可得:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H=(-905.5kJ•mol-1)-(+180kJ•mol-1)×2=-1625.5kJ/mol;
故答案为:-1625.5kJ/mol;
②据原子守恒和电子守恒,可以写为:4CO(NH2)2+6NO2═7N2+4CO2+8H2O,
故答案为:4CO(NH2)2+6NO2═7N2+4CO2+8H2O;
(2)①氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,amolNH3反应失去电子3amol,1mol O2得到4mol电子,bmolO2反应得到电子4bmol,则NO转化为N2得到的电子为$\frac{3a-4b}{2}$mol,
故答案为:$\frac{3a-4b}{2}$mol;
②V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成VOSO4,VOSO4 分解生成V2O5、SO2、SO3,
该催化循环机理的化学方程式为:
SO2+V2O5═SO3+V2O4,
2SO2+O2+V2O4=2VOSO4,
2VOSO4=V2O5+SO2+SO3,
故答案为:2SO2+O2+V2O4=2VOSO4;
③SO3进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵.分析n(NH3):n(SO3)对硫酸氢铵及硫酸铵形成的影响可知,三氧化硫越多生成产物为硫酸氢氨,氨气越多生成的产物为硫酸铵,则图5中A、C区域代表的物质分别为(NH4)2SO4,NH4HSO4;,
故答案为:(NH4)2SO4,NH4HSO4;
(3)①电解吸收也是脱硝的一种方法.用6%的稀硝酸吸收NOx生成亚硝酸[Ka(HNO2)=5.1×10-4],再将吸收液导入电解槽电解,使之转化为硝酸,阳极上亚硝酸失电子发生氧化反应,阳极电极反应为:H2O+HNO2-2e-=3H++NO3-,
故答案为:H2O+HNO2-2e-=3H++NO3-;
②O3也可用于烟气脱硝.二氧化氮中氮元素化合价+4价,O3氧化NO2的氧化产物为+5价氮的化合物为N2O5,故答案为:N2O5 .
点评 本题考查了盖斯定律的应用、化学方程式的书写、电解原理的应用、氧化还原反应、图象的分析与应用等,考查了学生的分析能力以及对基础知识的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 醋酸 | 碳酸 | 氨水 | 氯水 |
| B | 纯碱 | 碘酒 | 苛性钾 | 醋酸 | 干冰 |
| C | 石油 | 石灰石 | 硫酸 | 磷酸 | 水 |
| D | 烧碱 | 天然气 | 氯化钠 | 碳酸钠 | 蔗糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.6mol | |
| B. | 50mL 2mol•L-1的NaCl溶液和100 mL L 0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol•L-1 | |
| D. | 10g 98%的硫酸(密度为1.84g•cm-3)与10mL 18.4mol•L-1的硫酸的浓度是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q<0,m+n<x | B. | Q<0,m+n>x | C. | Q>0,m+n<x | D. | Q>0,m+n>x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热△H=-241.6 kJ•mol-1 | |
| B. | 等质量的H2、CO完全燃烧时,CO释放的热量更多 | |
| C. | 煤的气化的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=-131.1 kJ•mol-1 | |
| D. | 煤炭完全燃烧释放1967.5 kJ热量时转移20 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 现象或反应 | 原理解释 |
| A | 2CO=2C+O2在任何条件下均不能自发进行 | 该反应△H>0,△S>0 |
| B | 铝箔在酒精灯火焰上加热融化但不滴落 | Al2O3熔点高于Al单质 |
| C | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是被蒸馏物质的沸点 |
| D | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
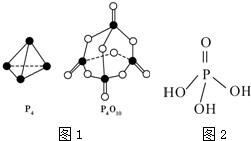
| 化学键 | P-P | P-O | P═O | O═O |
| 键能/kJ•mol-1 | a | b | c | d |
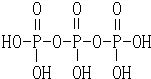 ,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应在较高温度下才能自发进行 | |
| B. | 该反应的正反应活化能小于逆反应活化能 | |
| C. | 该反应中,断裂化学键的总键能大于形成化学键的总键能 | |
| D. | 若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com